WikiDer > Давление газа

Давление газа (или давление пара в Британский английский; увидеть различия в написании) или же равновесное давление пара определяется как давление осуществляется пар в термодинамическое равновесие с этими конденсированный фазы (твердое или жидкое) при заданной температуре в закрытая система. Равновесное давление пара указывает на то, что жидкость испарение ставка. Это относится к тенденции частиц выходить из жидкости (или твердого тела). Вещество с высоким давлением пара при нормальных температурах часто называют летучий. Давление пара, присутствующего над поверхностью жидкости, известно как давление пара. По мере увеличения температуры жидкости увеличивается и кинетическая энергия ее молекул. По мере увеличения кинетической энергии молекул число молекул, переходящих в пар, также увеличивается, тем самым увеличивая давление пара.
Давление пара любого вещества нелинейно увеличивается с температурой в соответствии с Соотношение Клаузиуса – Клапейрона. В атмосферное давление точка кипения жидкости (также известной как нормальная точка кипения) - это температура, при которой давление пара равно атмосферному давлению окружающей среды. При любом постепенном повышении этой температуры давление пара становится достаточным для преодоления атмосферное давление и поднимите жидкость, чтобы образовать пузырьки пара внутри массы вещества. Пузырь пласт, более глубокий в жидкости, требует более высокой температуры из-за более высокого давления жидкости, потому что давление жидкости увеличивается выше атмосферного давления с увеличением глубины. На малых глубинах более важна более высокая температура, необходимая для начала образования пузырьков. Поверхностное натяжение стенки пузырька приводит к избыточному давлению в очень маленьких начальных пузырьках.
Давление пара, которое один компонент смеси вносит в общее давление в системе, называется частичное давление. Например, воздух на уровне моря, насыщенный водяным паром при 20 ° C, имеет парциальное давление около 2,3 кПа воды, 78 кПа давления воды. азот, 21 кПа кислород и 0,9 кПа аргон, всего 102,2 кПа, что составляет основу стандартное атмосферное давление.
Единицы измерения и единицы
Давление пара измеряется в стандартных единицах давление. В Международная система единиц (SI) признает давление как производная единица с размером силы на площадь и обозначает паскаль (Па) в качестве стандартной единицы. Один паскаль - это один ньютон на квадратный метр (Н · м−2 или кг · м−1· С−2).
Экспериментальное измерение давления пара - это простая процедура для обычных значений давления от 1 до 200 кПа.[1] Наиболее точные результаты получаются вблизи точки кипения веществ, а большие ошибки возникают при измерениях, меньших, чем 1кПа. Процедуры часто состоят из очистки испытуемого вещества, его изоляции в контейнере, откачивания любого постороннего газа, а затем измерения равновесного давления газовой фазы вещества в контейнере при различных температурах. Лучшая точность достигается, когда все вещество и его пары имеют заданную температуру. Это часто делается, например, с использованием изотенископпутем погружения защитной оболочки в ванну с жидкостью.
Очень низкое давление пара твердых веществ можно измерить с помощью Выпотная клетка Кнудсена метод.
В медицинском контексте давление пара иногда выражается в других единицах, в частности миллиметры ртутного столба (мм рт. ст.). Это важно для летучие анестетики, большинство из которых являются жидкостями при температуре тела, но с относительно высоким давлением пара.
Оценка давления пара с помощью уравнения Антуана
В Уравнение антуана[2][3] представляет собой прагматическое математическое выражение зависимости между давлением пара и температурой чистых жидких или твердых веществ. Он получается путем подбора кривой и адаптирован к тому факту, что давление пара обычно увеличивается и вогнутое в зависимости от температуры. Основная форма уравнения:
и его можно преобразовать в эту явную для температуры форму:
куда:
- абсолютное давление пара вещества
- это температура вещества
- , и коэффициенты, зависящие от вещества (т. е. константы или параметры)
- обычно либо или же [3]
Иногда используется более простая форма уравнения всего с двумя коэффициентами:
который можно преобразовать в:
Сублимации и испарения одного и того же вещества имеют отдельные наборы коэффициентов Антуана, как и компоненты в смесях.[2] Каждый набор параметров для определенного соединения применим только в указанном диапазоне температур. Обычно диапазоны температур выбираются таким образом, чтобы точность уравнения составляла от нескольких до 8–10 процентов. Для многих летучих веществ доступны несколько различных наборов параметров, которые используются для разных температурных диапазонов. Уравнение Антуана имеет низкую точность с любым набором параметров при использовании от точки плавления соединения до его критической температуры. Точность также обычно низкая, когда давление пара ниже 10 Торр из-за ограничений устройства.[нужна цитата] используется для установки значений параметров Антуана.
Уравнение Вагнера[4] дает "один из лучших"[5] соответствует экспериментальным данным, но является довольно сложным. Он выражает пониженное давление пара как функцию пониженной температуры.
Отношение к температуре кипения жидкостей
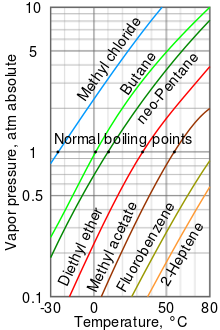
Как правило, давление паров жидкостей при температуре окружающей среды увеличивается с понижением температуры кипения. Это показано на диаграмме давления пара (см. Справа), на которой показаны графики давление пара в зависимости от температуры для самых разных жидкостей.[6] При нормальной температуре кипения жидкости давление пара равно стандартному атмосферному давлению, определяемому как 1 атмосфера,[7] 760 Торр, 101,325 кПа, или 14,69595 psi.
Например, при любой заданной температуре метилхлорид имеет самое высокое давление пара среди всех жидкостей в таблице. Он также имеет самую низкую нормальную точку кипения (-24,2 ° C), где кривая давления паров хлористого метила (синяя линия) пересекает горизонтальную линию давления в одну атмосферу (банкомат) абсолютного давления пара.
Хотя соотношение между давлением пара и температурой является нелинейным, на диаграмме используется логарифмическая вертикальная ось для получения слегка изогнутых линий, поэтому на одной диаграмме можно отобразить множество жидкостей. Почти прямая линия получается, когда логарифм давления пара наносится на график против 1 / (T + 230)[8] где T - температура в градусах Цельсия. Давление пара жидкости в точке кипения равно давлению окружающей среды.
Жидкие смеси: закон Рауля
Закон Рауля дает приближение к давлению паров смесей жидкостей. В нем говорится, что активность (давление или летучесть) однофазной смеси равна молярно-взвешенной сумме давлений паров компонентов:
куда - давление паров смеси, это мольная доля компонента в жидкой фазе и это мольная доля компонента в паровой фазе соответственно. давление паров компонента . Закон Рауля применим только к неэлектролитам (незаряженным частицам); он наиболее подходит для неполярных молекул со слабым межмолекулярным притяжением (например, Лондонские силы).
Считается, что системы с давлением пара выше, чем указано в приведенной выше формуле, имеют положительные отклонения. Такое отклонение предполагает более слабое межмолекулярное притяжение, чем в чистых компонентах, так что можно думать, что молекулы «удерживаются» в жидкой фазе менее сильно, чем в чистой жидкости. Примером может служить азеотроп приблизительно 95% этанола и воды. Поскольку давление паров азеотропа выше, чем предсказывается законом Рауля, он кипит при температуре ниже температуры любого из чистых компонентов.
Существуют также системы с отрицательными отклонениями, в которых давление пара ниже ожидаемого. Такое отклонение свидетельствует о более сильном межмолекулярном притяжении между составляющими смеси, чем существует в чистых компонентах. Таким образом, молекулы «удерживаются» в жидкости сильнее, когда присутствует вторая молекула. Примером может служить смесь трихлорметана (хлороформа) и 2-пропанона (ацетон), которая кипит выше точки кипения любого из чистых компонентов.
Отрицательные и положительные отклонения могут использоваться для определения термодинамическая активность коэффициенты компонентов смесей.
Твердые тела
Равновесное давление пара можно определить как давление, достигаемое, когда конденсированная фаза находится в равновесии со своим собственным паром. В случае равновесного твердого тела, такого как кристалл, это можно определить как давление, когда скорость сублимация твердого тела соответствует скорости осаждения его паровой фазы. Для большинства твердых веществ это давление очень низкое, но есть некоторые заметные исключения: нафталин, сухой лед (давление пара сухого льда составляет 5,73 МПа (831 фунт / кв. дюйм, 56,5 атм) при 20 ° C, что приводит к разрыву большинства герметичных контейнеров) и льда. Все твердые материалы обладают давлением пара. Однако из-за их часто очень низких значений измерение может быть довольно трудным. Типичные методы включают использование термогравиметрия и транспирация газа.
Существует ряд методов расчета давления сублимации (т. Е. Давления пара) твердого тела. Один из методов заключается в оценке давления сублимации по экстраполированному давлению паров жидкости (переохлажденной жидкости), если теплота плавления известно с использованием этой конкретной формы соотношения Клаузиуса – Клапейрона:[9]
куда:
- - давление сублимации твердого компонента при температуре .
- - экстраполированное давление пара жидкого компонента при температуре .
- это тепло плавления.
- это газовая постоянная.
- - температура сублимации.
- - температура плавления.
Этот метод предполагает, что теплота плавления не зависит от температуры, игнорирует дополнительные температуры перехода между различными твердыми фазами, и дает справедливую оценку для температур, не слишком далеко от точки плавления. Он также показывает, что давление сублимации ниже экстраполированного давления пара жидкости (ΔсуетитьсяЧАС > 0) и разница растет с удалением от точки плавления.
Температура кипения воды
Как и все жидкости, вода закипает, когда давление пара достигает окружающего давления. В природе атмосферное давление ниже на возвышенностях и вода закипает при более низкой температуре. Температуру кипения воды при атмосферном давлении можно приблизительно оценить по формуле Уравнение антуана:
или преобразованный в эту явную форму температуры:
где температура это температура кипения в градусах Цельсия и давление в Торр.
Правило Дюринга
Правило Дюринга утверждает, что существует линейная зависимость между температурами, при которых два раствора оказывают одинаковое давление пара.
Примеры
В следующей таблице приведен список различных веществ, упорядоченных по возрастанию давления пара (в абсолютных единицах).
| Вещество | Давление газа | Температура (° C) | ||
|---|---|---|---|---|
| (Па) | (бар) | (мм рт. ст.) | ||
| Вольфрам | 100 Па | 0.001 | 0.75 | 3203 |
| Ксенон дифторид | 600 Па | 0.006 | 4.50 | 25 |
| Вода (ЧАС2O) | 2,3 кПа | 0.023 | 17.5 | 20 |
| Пропанол | 2,4 кПа | 0.024 | 18.0 | 20 |
| Метилизобутилкетон | 2,66 кПа | 0.0266 | 19.95 | 25 |
| Этиловый спирт | 5,83 кПа | 0.0583 | 43.7 | 20 |
| Фреон 113 | 37,9 кПа | 0.379 | 284 | 20 |
| Ацетальдегид | 98,7 кПа | 0.987 | 740 | 20 |
| Бутан | 220 кПа | 2.2 | 1650 | 20 |
| Формальдегид | 435,7 кПа | 4.357 | 3268 | 20 |
| Пропан[10] | 997,8 кПа | 9.978 | 7584 | 26.85 |
| Карбонилсульфид | 1,255 МПа | 12.55 | 9412 | 25 |
| Оксид азота[11] | 5,660 МПа | 56.60 | 42453 | 25 |
| Углекислый газ | 5,7 МПа | 57 | 42753 | 20 |
Оценка давления пара по молекулярной структуре
Существует несколько эмпирических методов оценки давления пара на основе молекулярной структуры органических молекул. Некоторые примеры: метод SIMPOL.1,[12] метод Moller et al.,[9] и ИСПАРЕНИЕ (оценка давления пара органических веществ, учет температуры, внутримолекулярных и неаддитивных эффектов).[13][14]
Значение в метеорологии
В метеорология, период, термин давление газа используется для обозначения парциального давления водяной пар в атмосфере, даже если она не находится в равновесии,[15] и равновесное давление пара указано иначе. Метеорологи также используют термин давление насыщенного пара для обозначения равновесного давления пара воды или рассол над плоской поверхностью, чтобы отличить его от равновесного давления пара, которое учитывает форму и размер водяных капель и твердых частиц в атмосфере.[16]
Смотрите также
- Давление паров воды
- Абсолютная влажность
- Уравнение антуана
- Метод Ли – Кеслера
- Закон Рауля: снижение давления пара в растворе
- Давление паров по Рейду
- Относительная влажность
- Относительная волатильность
- Плотность насыщенного пара
- Осмотический коэффициент
- Тройная точка
- Истинное давление пара
- Парожидкостное равновесие
- Давление паров элементов (страница данных)
Рекомендации
- ^ Ружичка, К .; Фулем М. и Ружичка В. «Давление паров органических соединений. Измерение и корреляция» (PDF). Архивировано из оригинал (PDF) на 2010-12-26. Получено 2009-10-18.
- ^ а б Что такое уравнение Антуана? (Химический факультет, Государственный университет Фростбурга, Мэриленд)
- ^ а б Синнот, Р. (2005). Химико-технологический дизайн] (4-е изд.). Баттерворт-Хайнеманн. п. 331. ISBN 978-0-7506-6538-4.
- ^ Вагнер, В. (1973), «Новые измерения давления пара для аргона и азота и новый метод для создания рациональных уравнений давления пара», Криогеника, 13 (8): 470–482, Bibcode:1973Cryo ... 13..470 Вт, Дои:10.1016/0011-2275(73)90003-9
- ^ Справочник инженеров-химиков Перри, 7-е изд. стр. 4–15
- ^ Perry, R.H .; Грин Д.У., ред. (1997). Справочник инженеров-химиков Перри (7-е изд.). Макгроу-Хилл. ISBN 978-0-07-049841-9.
- ^ Petrucci, Ralph H .; Харвуд, Уильям S .; Херринг, Ф. Джеффри (2002). Общая химия (8-е изд.). Прентис Холл. п.484. ISBN 978-0-13-014329-7.
- ^ Дрейсбах Р. и Спенсер Р. С. (1949). «Бесконечные точки семейств диаграмм Кокса и значения dt / dP при любом давлении». Промышленная и инженерная химия. 41 (1). п. 176. Дои:10.1021 / ie50469a040.
- ^ а б Moller B .; Рэри Дж .; Рамджугернатх Д. (2008). «Оценка давления паров неэлектролитных органических соединений через групповые вклады и групповые взаимодействия». Журнал молекулярных жидкостей. 143: 52–63. Дои:10.1016 / j.molliq.2008.04.020.
- ^ "Теплофизические свойства жидкостей II - метана, этана, пропана, изобутана и нормального бутана" (страница 110 PDF, страница 686 исходного документа), BA Younglove и JF Ely.
- ^ "Теплофизические свойства закиси азота" (страница 14 PDF, страница 10 исходного документа), ESDU.
- ^ Pankow, J. F .; и другие. (2008). «SIMPOL.1: простой метод группового вклада для прогнозирования давления пара и энтальпии испарения многофункциональных органических соединений». Атмос. Chem. Phys. 8 (10): 2773–2796. Дои:10.5194 / acp-8-2773-2008.
- ^ «Давление пара чистых жидких органических соединений: оценка ИСПАРЕНИЕМ». Моделирование химии тропосферы в BIRA-IASB. 11 июня 2014 г.. Получено 2018-11-26.
- ^ Compernolle, S .; и другие. (2011). «ИСПАРЕНИЕ: новый метод оценки давления пара для органических молекул, включая неаддитивность и внутримолекулярные взаимодействия». Атмос. Chem. Phys. 11 (18): 9431–9450. Bibcode:2011ACP .... 11.9431C. Дои:10.5194 / acp-11-9431-2011.
- ^ Глоссарий В архиве 2011-04-15 на Wayback Machine (Разработано Американское метеорологическое общество)
- ^ Краткое руководство. jhuapl.edu (Статья об определении равновесного давления пара)