WikiDer > Аммиак (страница данных)
На этой странице представлены дополнительные химические данные о аммиак.
Структура и свойства
| Молекулярная структура | |
|---|---|
| Группа точек | C3в |
| Длина скрепления | 101.2 вечера (N – H)[1] |
| Угол крепления | 106,7 ° (H – N – H)[1] |
| Прочность сцепления | 435 кДж / моль (H – NH2) |
| Кристаллические данные | |
| Кристальная структура | ? |
| Характеристики | |
| Дипольный момент | 1.46 D |
| Диэлектрическая постоянная | 22 ε0 при 239 К |
| Магнитная восприимчивость | диамагнитный |
| Кислотность NH4+ (пKа) | 9.25 |
Термодинамические свойства
| Фазовое поведение | |
|---|---|
| Тройная точка | 195,4 К (–77,75 ° С), 6,060 КПа |
| Критическая точка | 405,5 К (132,3 ° С), 11,300 МПа |
| Стандартное изменение энтальпии сплава, ΔсуетитьсяЧАС | +5,653 кДж / моль |
| Стандартное изменение энтропии сплава, ΔсуетитьсяS | +28,93 Дж / (моль · К) |
| Стандартное изменение энтальпии испарения, ΔvapЧАС | +23,35 кДж / моль при BP –33,4 ° C |
| Стандартное изменение энтропии испарения, ΔvapS | +97,41 Дж / (моль · К) при BP –33,4 ° C |
| Твердые свойства | |
| Стандартное изменение энтальпии формирования, ΔжЧАС | ? кДж / моль |
| Стандартная молярная энтропия, S | ? Дж / (моль К) |
| Теплоемкость, cп | ? Дж / (моль К) |
| Жидкие свойства | |
| Стандартное изменение энтальпии формирования, ΔжЧАС | ? кДж / моль |
| Стандартная молярная энтропия, S | ? Дж / (моль К) |
| Теплоемкость, cп | 80,80 Дж / (моль К) |
| Свойства газа | |
| Стандартное изменение энтальпии формирования, ΔжЧАС | -45,92 кДж / моль |
| Стандартное Свободная энергия Гиббса изменять формации, Δжграмм | −16,6 кДж / моль |
| Стандартная молярная энтропия, S | 192,77 Дж / (моль К) |
| Теплоемкость, cп | 35,06 Дж / (моль К) |
| Коэффициент теплоемкости, γ при 15 ° C | 1.310 |
| константы Ван-дер-Ваальса | a = 422,5 литра2 kПа / крот2 b = 0,03707 л / моль |
Данные о равновесии пар-жидкость
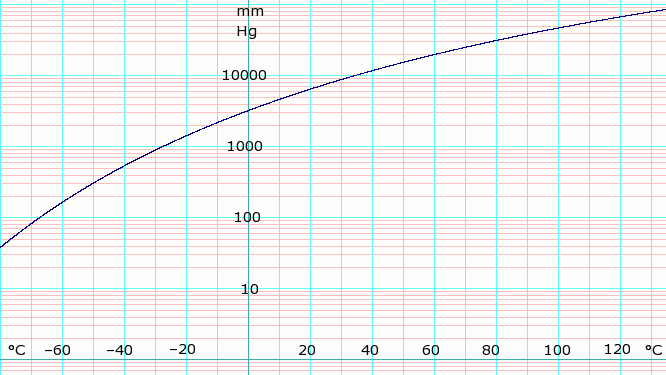
| P в мм рт. Ст. | 1 | 10 | 40 | 100 | 400 | 760 | 1520 | 3800 | 7600 | 15600 | 30400 | 45600 | |
| Т в ° C | −109.1(s) | −91.9(s) | −79.2(s) | −68.4 | −45.4 | −33.6 | −18.7 | 4.7 | 25.7 | 50.1 | 78.9 | 98.3 | |
Табличные данные (см. Выше) получены из CRC Справочник по химии и физике 44-е изд. Обозначение (s) указывает на равновесную температуру пара над твердым телом. В противном случае температура - это равновесие пара над жидкостью.
Формула давления пара для аммиака:[2]
- бревно10п = А – B / (Т − C),
куда п давление в кПа, и Т это температура в кельвины;
- А = 6.67956, B = 1002.711, C = 25,215 для Т = От 190 К до 333 К.
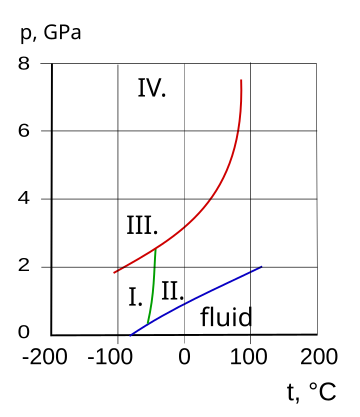
| 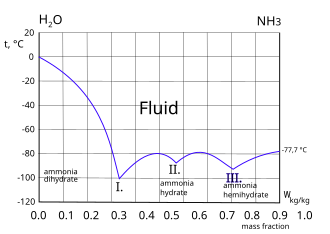 Кривая замерзания аммиачно-водяной системы. Три эвтектические точки I. II. и III. показаны. Слева от точки I. замороженный компонент - лед. Право III. точка замороженного компонента - аммиак.[4]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Теплоемкость жидкости и пара
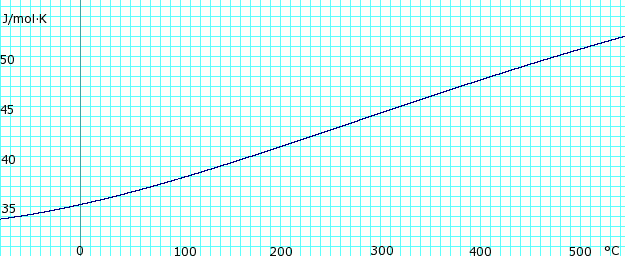 Теплоемкость, cп, газообразного аммиака безводного. Использует полином, полученный из CHERIC.[6] |
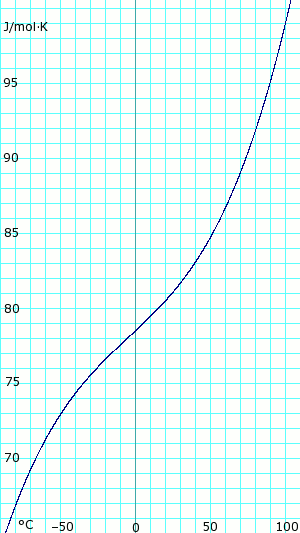 Теплоемкость безводного жидкого аммиака. Использует полином, полученный из CHERIC.[6] |
Спектральные данные
| УФ-видимый | |
|---|---|
| λМаксимум | Никто нм |
| Коэффициент экстинкции, ε | Никто |
| ИК | |
| Основные полосы поглощения | 3444, 3337, 1627, 950 см−1 |
| ЯМР | |
| Протонный ЯМР | |
| Углерод-13 ЯМР | Нет - без углерода |
| Другие данные ЯМР | |
| РС | |
| Массы основные фрагменты | 17 (100%) 16(80%) 15(9%) |
Нормативные данные
| Нормативные данные | |
|---|---|
| Номер EINECS | 231-635-3 (газ) 215-647-6 (soln.) |
| Индексный номер ЕС | 007-001-00-5 (газ) 007-001-01-2 (soln.) |
| PEL-TWA (OSHA) | 50 частей на миллион (35 мг / м3) |
| IDLH (NIOSH) | 300 частей на миллион |
| точка возгорания | 11 ° С |
| температура самовоспламенения | 651 ° С |
| Пределы взрываемости | 15–28% |
| RTECS # | BO0875000 |
Паспорт безопасности
Обращение с этим химическим веществом может повлечь за собой значительные меры предосторожности ... Настоятельно рекомендуется обратиться к Паспорту безопасности (SDS) для этого химического вещества из надежного источника и следуйте его указаниям.
Рекомендации
- Линстром, Питер Дж .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov
- ^ а б CRC Справочник по химии и физике, 94-е изд. http://www.hbcpnetbase.com. Стр. 9-26. Проверено 18 июня 2013 года.
- ^ Справочник Ланге по химии, 10-е изд. стр. 1436.
- ^ Справочник Ланге по химии, 10-е изд. стр. 1451 и 1468.
- ^ Фридрих Меркель, Франьо Бошнякович (1929). Diagramme und Tabellen zur Berechnung der Absorptions-Kältemachienen. Берлин: Юлиус Спрингер. п. 46.
- ^ Пермань, Jour. Chem. Soc. 83 1168 (1903).
- ^ а б «Свойства чистых компонентов» (Запрашиваемая база данных). Информационный центр исследований химической инженерии. В архиве из оригинала от 3 июня 2007 г.. Получено 1 июня 2007.
Если не указано иное, данные относятся к стандартная температура и давление окружающей среды.
Отказ от ответственности применяется.