WikiDer > Уравнение Ван-дер-Ваальса
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
В химия и термодинамика, то уравнение Ван-дер-Ваальса (или же уравнение состояния Ван-дер-Ваальса; назван в честь голландского физика Йоханнес Дидерик ван дер Ваальс) является уравнение состояния это обобщает закон идеального газа на основе правдоподобных причин, что настоящие газы не действовать в идеале. Закон идеального газа относится к газу молекулы так как точечные частицы которые взаимодействуют со своими контейнерами, но не друг с другом, то есть они не занимают места и не меняются кинетическая энергия в течение столкновения (т.е. все столкновения идеально эластичный).[1] Закон идеального газа гласит, что объем (V) занят п родинки любого газа имеет давление (п) в температура (Т) в кельвины задается следующим соотношением, где р это газовая постоянная:
Для учета громкость что занимает молекула реального газа, уравнение Ван-дер-Ваальса заменяет V в законе идеального газа с , куда Vм это молярный объем газа и б - объем, который занимает один моль молекул. Это ведет к:[1]
Вторая модификация, внесенная в закон идеального газа, объясняет тот факт, что молекулы газа действительно взаимодействуют друг с другом (они обычно испытывают притяжение при низких давлениях и отталкивание при высоких давлениях), и поэтому реальные газы показывают другую сжимаемость, чем идеальные газы. Ван дер Ваальс предусмотрел межмолекулярное взаимодействие добавив к наблюдаемому давлению п в уравнении состояния член , куда а - константа, значение которой зависит от газа. В уравнение Ван-дер-Ваальса поэтому записывается как:[1]
и также может быть записано как уравнение ниже:
куда Vм молярный объем газа, р - универсальная газовая постоянная, Т это температура, п это давление, и V объем. Когда молярный объем Vм большой, б становится незначительным по сравнению с Vм, среднийм2 становится незначительным по отношению к п, а уравнение Ван-дер-Ваальса сводится к закону идеального газа: PVм= RT.[1]
Он доступен через его традиционный вывод (механическое уравнение состояния) или через вывод, основанный на статистическая термодинамика, последний из которых обеспечивает функция распределения системы и позволяет задавать термодинамические функции. Он успешно приближает поведение реального жидкости выше их критические температуры и качественно разумно для их жидкость и низкого давления газообразный состояния при низких температурах. Однако рядом с фазовые переходы между газом и жидкостью, в диапазоне п, V, и Т где жидкая фаза и газовая фаза находятся в равновесие, уравнение Ван-дер-Ваальса не может точно моделировать наблюдаемое экспериментальное поведение, в частности, что п постоянная функция V при заданных температурах. Таким образом, модель Ван-дер-Ваальса не пригодна только для расчетов, предназначенных для прогнозирования реального поведения в регионах вблизи критическая точка. С тех пор были внесены исправления для устранения этих прогностических недостатков, например, правило равных площадей или принцип соответствующих состояний.
Обзор и история
Эта секция нуждается в расширении с: правильное простое объяснение уравнения, истории и контекста его открытия. Вы можете помочь добавляя к этому. (Июнь 2015 г.) |
Уравнение Ван-дер-Ваальса представляет собой термодинамический уравнение состояния на основе теория который жидкости состоят из частиц с ненулевым объемом и подвержены (не обязательно попарно) межчастичному притяжению. сила.[нужна цитата] Он был основан на работе в теоретической физическая химия в исполнении в конце 19 века Йоханнес Дидерик ван дер Ваальс, которые работали над привлекательными сила который также носит его имя.[нужна цитата] Уравнение, как известно, основано на традиционном наборе выводов, полученных в результате усилий Ван-дер-Ваальса и связанных с ним:[нужна цитата] а также набор производных на основе статистическая термодинамика,[нужна цитата] Смотри ниже.
Ранние интересы Ван дер Ваальса были в основном в области термодинамика, где первое влияние было Рудольф Клаузиусопубликовал труд по теплу 1857 г .; другое значительное влияние оказали сочинения Джеймс Клерк Максвелл, Людвиг Больцманн, и Уиллард Гиббс.[2] После первоначального стремления к преподавательской деятельности, Ван дер Ваальс закончил курс математики и физики в бакалавриате. Лейденский университет в Нидерланды привели (со значительными препятствиями) к его принятию в докторантуру в Лейдене при Питер Рийке. Его диссертация помогает объяснить экспериментальное наблюдение 1869 года ирландским профессором химии. Томас Эндрюс (Королевский университет Белфаста) существования критическая точка в жидкостях,[3][неосновной источник необходим] историк науки Мартин Дж. Кляйн заявляет, что неясно, знал ли ван дер Ваальс о результатах Эндрюса, когда он начинал свою докторскую работу.[4] Докторские исследования Ван дер Ваальса завершились диссертацией 1873 года, в которой была предложена полуколичественная теория, описывающая изменение состояния газ-жидкость и происхождение критической температуры. Over de Continuiteit van den Gas-en Vloeistof [-] toestand (Голландский; на английском, О непрерывности газового и жидкого состояний); именно в этой диссертации были сделаны первые выводы о том, что мы сейчас называем уравнение Ван-дер-Ваальса появившийся.[5] Джеймс Клерк Максвелл рассмотрел и похвалил опубликованный контент в британском научном журнале. Природа,[6][7] и ван дер Ваальс начал независимую работу, в результате которой он получил Нобелевская премия в 1910 г., что подчеркнуло вклад его формулировки «уравнения состояния для газов и жидкостей».[2]
Уравнение

Уравнение связывает четыре переменных состояния: давление жидкости п, общий объем емкости с жидкостью V, то количество частиц N, а абсолютная температура системы Т.
В интенсивный, микроскопическая форма уравнения:
куда
- объем контейнера, занимаемый каждой частицей (не скорость частицы), и kB это Постоянная Больцмана. Он вводит два новых параметра: а′, Мера среднего притяжения между частицами, и б′, Исключенный из v одной частицей.
Уравнение также можно записать в расширенной молярной форме:
куда
является мерой среднего притяжения между частицами,
- объем, исключенный моль частиц,
это количество родинок,
универсальный газовая постоянная, kB - постоянная Больцмана, а NА это Константа Авогадро.
Следует проводить тщательное различие между объемом доступен частица и объем из частица.[согласно кому?] В интенсивном уравнении v равняется общему пространству, доступному каждой частице, а параметр б′ Пропорционален собственному объему отдельной частицы - объему, ограниченному радиус атома. Это вычитается из v из-за пространства, занимаемого одной частицей.[нужна цитата] В первоначальном выводе Ван-дер-Ваальса, приведенном ниже, б ' в четыре раза больше собственного объема частицы. Отметим далее, что давление п уходит в бесконечность, когда контейнер полностью заполнен частицами, так что не остается пустого пространства для движения частиц; это происходит, когда V = nb.[9]
Газовая смесь
Если смесь рассматриваются газы, и каждый газ имеет свой (притяжение между молекулами) и (объем, занимаемый молекулами) значений, то и для смеси можно рассчитать как
- = общее количество присутствующих молей газа,
- для каждого , = количество молей газа настоящее и
- [10][11]
- [10][11]
и правило добавления парциальные давления становится недействительным, если числовой результат уравнения существенно отличается от уравнение идеального газа .
Уменьшенная форма
Уравнение Ван-дер-Ваальса также можно выразить через уменьшенные свойства:
Это дает критический коэффициент сжимаемости из 3/8. Причины модификации уравнения идеального газа: Состояние уравнения для идеального газа PV = RT. При выводе законов идеального газа на основе кинетической теории газов были сделаны некоторые предположения.
Период действия
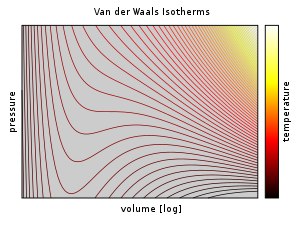
В уравнение Ван-дер-Ваальса математически прост, но тем не менее предсказывает экспериментально наблюдаемые переход между паром и жидкостью и предсказывает критическое поведение.[12]:289 Он также адекватно предсказывает и объясняет Эффект Джоуля – Томсона, что невозможно в идеальном газе.
Выше критическая температура, ТC, уравнение Ван-дер-Ваальса является улучшением по сравнению с законом идеального газа, и для более низких температур, т. е. Т < ТC, уравнение также качественно разумно для жидкого и газообразного состояний низкого давления; однако по отношению к фазовому переходу первого рода, т. е. диапазон (р, В, Т) где жидкость фаза и газ фаза будет в равновесии, уравнение не может предсказать наблюдаемое экспериментальное поведение в том смысле, что п обычно наблюдается, чтобы быть постоянным как функция V для заданной температуры в двухфазной области. Это кажущееся несоответствие разрешается в контексте парожидкостного равновесия: при определенной температуре существуют две точки на изотерме Ван-дер-Ваальса с одинаковым химическим потенциалом, и, таким образом, система в термодинамическом равновесии будет пересекать прямую на п–V диаграмма при изменении отношения пара к жидкости. Однако в такой системе на самом деле присутствуют только две точки (жидкость и пар), а не серия состояний, соединенных линией, поэтому соединение геометрического места точек неверно: это не уравнение нескольких состояний, а уравнение (единственного) состояния. Действительно, возможно сжимать газ выше точки, в которой он обычно конденсируется, при правильных условиях, а также можно расширять жидкость выше точки, в которой она обычно кипит. Такие состояния называются «метастабильными» состояниями. Такое поведение качественно (хотя, возможно, и не количественно) предсказывается уравнением состояния Ван-дер-Ваальса.[13]
Однако значения физических величин, предсказанные уравнением состояния Ван-дер-Ваальса, «очень плохо согласуются с экспериментом», поэтому полезность модели ограничивается качественными, а не количественными целями.[12]:289 Поправки, основанные на эмпирических данных, легко могут быть внесены в модель Ван-дер-Ваальса (см. Поправка Максвелланиже), но при этом модифицированное выражение перестает быть простой аналитической моделью; в связи с этим другие модели, например, основанные на принцип соответствующих состояний, добиться лучшего совпадения примерно с той же работой.[нужна цитата]Даже при признанных недостатках повсеместное использование уравнение Ван-дер-Ваальса в стандартном университете физическая химия учебники ясно показывают его важность как педагогического инструмента, помогающего понять фундаментальные идеи физической химии, используемые при разработке теорий поведения пара-жидкости и уравнений состояния.[14][15][16] Кроме того, другие (более точные) уравнения состояния, такие как Redlich – Kwong и Peng – Robinson уравнение состояния являются модификациями уравнения состояния Ван-дер-Ваальса.
Вывод
Учебники по физической химии обычно дают два производные титульного уравнения.[ВОЗ?] Один из них - это традиционный вывод, восходящий к Ван-дер-Ваальсу, механическое уравнение состояния, которое нельзя использовать для определения всех термодинамических функций; другой вывод - это статистическая механика, в котором явно указывается межмолекулярный потенциал, которым пренебрегли в первом выводе.[нужна цитата] Особое преимущество статистического механического вывода состоит в том, что он дает статистическую сумму для системы и позволяет задавать все термодинамические функции (включая механическое уравнение состояния).[нужна цитата]
Обычное происхождение
Рассмотрим один моль газа, состоящий из невзаимодействующих точечных частиц, которые удовлетворяют закону идеального газа: (см. Любой стандартный текст по физической химии, op. Cit.)
Далее предположим, что все частицы являются твердыми сферами одного и того же конечного радиуса. р (в радиус Ван-дер-Ваальса). Эффект конечного объема частиц заключается в уменьшении доступного пустого пространства, в котором частицы могут свободно перемещаться. Мы должны заменить V к V − б, куда б называется исключенный объем или «совместный объем». Исправленное уравнение становится
Исключенный объем не просто равен объему, занимаемому твердыми частицами конечного размера, но фактически в четыре раза превышает общий молекулярный объем одного моля газа Ван-дер-Ваальса. Чтобы увидеть это, мы должны понимать, что частица окружена сферой радиуса 2р (в два раза превышающий исходный радиус), что запрещено для центров других частиц. Если бы расстояние между центрами двух частиц было меньше 2р, это означало бы, что две частицы проникают друг в друга, чего, по определению, твердые сферы не могут сделать.
Исключенный объем для двух частиц (среднего диаметра d или радиус р) является
- ,
что, разделенное на два (количество сталкивающихся частиц), дает исключенный объем на одну частицу:
- ,
Так б ' в четыре раза больше собственного объема частицы. Ван-дер-Ваальса беспокоило то, что множитель четыре дает верхнюю границу; эмпирические значения для б ' обычно ниже. Конечно, молекулы не бесконечно твердые, как думал Ван-дер-Ваальс, и часто бывают довольно мягкими.
Затем мы вводим (не обязательно попарно) силу притяжения между частицами. Ван дер Ваальс предположил, что, несмотря на существование этой силы, плотность жидкости однородна; кроме того, он предположил, что диапазон силы притяжения настолько мал, что подавляющее большинство частиц не считает контейнер конечного размера.[нужна цитата] Учитывая однородность жидкости, большая часть частиц не испытывает суммарной силы, тянущей их вправо или влево. Иначе обстоит дело с частицами в поверхностных слоях, непосредственно прилегающих к стенкам. Они ощущают результирующую силу от объемных частиц, втягивающих их в контейнер, потому что эта сила не компенсируется частицами на той стороне, где находится стенка (другое предположение здесь заключается в том, что нет взаимодействия между стенками и частицами, что неверно, как это видно из явления образования капель; большинство типов жидкости демонстрируют адгезию). Эта результирующая сила уменьшает силу, прилагаемую к стенке частицами поверхностного слоя. Суммарная сила, действующая на поверхностную частицу, втягивающую ее в контейнер, пропорциональна числовой плотности. Рассматривая один моль газа, количество частиц будет NА
- .
Число частиц в поверхностных слоях, опять же в предположении однородности, также пропорционально плотности. В целом сила, действующая на стенки, уменьшается в раз, пропорциональном квадрату плотности, а давление (сила на единицу поверхности) уменьшается на
- ,
так что
При написании п по количеству родинок и нВм = V, уравнение принимает вторую форму, приведенную выше:
Представляет некоторый исторический интерес отметить, что ван дер Ваальс в своей лекции о Нобелевской премии дал высокую оценку Лаплас за аргумент, что давление уменьшается пропорционально квадрату плотности.[нужна цитата]
Вывод статистической термодинамики
Канонический функция распределения Z идеального газа, состоящего из N = nNА идентичный (невзаимодействующий) частиц, составляет:[17][18]
куда это тепловая длина волны де Бройля,
с обычными определениями: час является Постоянная Планка, м масса частицы, k Постоянная Больцмана и Т абсолютная температура. В идеальном газе z - статистическая сумма отдельной частицы в контейнере объемом V. Теперь, чтобы вывести уравнение Ван-дер-Ваальса, мы предполагаем, что каждая частица движется независимо в среднем потенциальном поле, предлагаемом другими частицами. Усреднение по частицам выполняется легко, поскольку мы будем предполагать, что плотность частиц жидкости Ван-дер-Ваальса однородна. Взаимодействие между парой частиц, которые являются твердыми сферами, принимается равным
р расстояние между центрами сфер и d расстояние, на котором твердые сферы соприкасаются друг с другом (удвоенный радиус Ван-дер-Ваальса). Глубина колодца Ван-дер-Ваальса составляет .
Поскольку частицы не связаны под действием гамильтониана среднего поля, приближение среднего поля полной статистической суммы по-прежнему факторизуется:
- ,
но межмолекулярный потенциал требует двух модификаций z. Во-первых, из-за конечного размера частиц не все V доступно, но только V - Nb ', где (как и в обычном выводе выше)
- .
Во-вторых, мы вставляем факторэкспресс Больцмана [ - ϕ / 2kT], чтобы позаботиться о среднем межмолекулярном потенциале. Мы делим здесь потенциал на два, потому что энергия взаимодействия распределяется между двумя частицами. Таким образом
Общее притяжение, которое испытывает отдельная частица, равно
где предполагалось, что в оболочке толщиной dр есть N / V 4π р2доктор частицы. Это приближение среднего поля; положение частиц усредняется. В действительности плотность вблизи частицы отличается от плотности вдали, что можно описать парной корреляционной функцией. Кроме того, не учитывается, что жидкость заключена между стенками. Выполняя интеграл, получаем
Отсюда получаем
Из статистической термодинамики мы знаем, что
- ,
так что нам нужно различать только члены, содержащие V. Мы получаем
Правило Максвелла равных площадей

Ниже критической температуры уравнение Ван-дер-Ваальса, по-видимому, предсказывает качественно неверные соотношения. В отличие от идеальных газов, изотермы p-V колеблются с относительным минимумом (d) и относительный максимум (е). Любое давление между пd и пе имеет 3 стабильных объема, что противоречит экспериментальному наблюдению, что две переменные состояния полностью определяют состояние однокомпонентной системы.[19] Кроме того, изотермический сжимаемость отрицательный между d и е (эквивалентно ), который не может описать систему в состоянии равновесия.[20]
Чтобы решить эти проблемы, Джеймс Клерк Максвелл заменил изотерму между точками а и c с горизонтальной линией, расположенной так, чтобы площади двух заштрихованных областей были равны (заменяя а-d-б-е-c кривая с прямой линией от а к c); эта часть изотермы соответствует равновесию жидкость-пар. Области изотермы от а–d и из c–е интерпретируются как метастабильные состояния перегретой жидкости и переохлажденного пара соответственно.[21][22] Правило равных площадей может быть выражено как:
куда пV - давление пара (пологий участок кривой), VL - объем чистой жидкой фазы в точке а на диаграмме, а Vграмм - объем чистой газовой фазы в точке c на схеме.[нужна цитата] Двухфазная смесь при пV будет занимать общий объем между VL и Vграмм, как определено Максвеллом правило рычага.
Максвелл обосновал правило тем, что площадь на pV диаграмма соответствует механической работе, что говорит о том, что работа, выполненная в системе, начиная с c к б должен равняться работе, высвобожденной при а к б. Это потому, что изменение свободной энергии А(Т,V) равняется работе, проделанной во время обратимого процесса, и, как переменная состояния, свободная энергия должна быть независимой от пути. В частности, значение А в точке б должен быть одинаковым независимо от того, идет ли путь слева или справа через горизонтальную изобару или следует исходной изотерме Ван-дер-Ваальса.[нужна цитата]
Этот вывод не совсем строг, так как он требует обратимого пути через область термодинамической нестабильности, в то время как б нестабильно.[требуется разъяснение][нужна цитата] Тем не менее современные производные от химический потенциал приходят к такому же выводу, и это остается необходимой модификацией ван-дер-Ваальса и любого другого аналитического уравнения состояния.[19]
От химического потенциала
Правило равных площадей Максвелла также может быть выведено из предположения равных химический потенциал μ сосуществующих жидкой и паровой фаз.[23][неосновной источник необходим] На изотерме, представленной на графике выше, точки а и c являются единственной парой точек, которые удовлетворяют условию равновесия, имея равное давление, температуру и химический потенциал. Отсюда следует, что системы с объемами, промежуточными между этими двумя точками, будут состоять из смеси чистой жидкости и газа с удельными объемами, равными чистой жидкой и газовой фазам в точках а и c.
Уравнение Ван-дер-Ваальса может быть решено относительно Vграмм и VL как функции температуры и давления пара пV.[нужна цитата] С:[согласно кому?]
куда А это свободная энергия Гельмгольца, отсюда следует, что правило равных площадей может быть выражено как:
- является
Поскольку объемы газа и жидкости являются функциями пV и Т только это уравнение затем решается численно, чтобы получить пV как функция температуры (и количества частиц N), который затем можно использовать для определения объемов газа и жидкости.[нужна цитата]
Псевдо-трехмерный график геометрического места объемов жидкости и пара в зависимости от температуры и давления показан на сопровождающем рисунке. Видно, что эти две точки гладко пересекаются в критической точке (1,1,1). Изотерма жидкости Ван-дер-Ваальса, полученная при Т р = 0,90 также показано, где пересечения изотермы с локусами иллюстрируют требование конструкции о том, что две области (показаны красная и синяя) равны.
Другие параметры, формы и приложения
Другие термодинамические параметры
Мы повторяем, что обширный том V связано с объемом, приходящимся на одну частицу v = V / N куда N = nNА - количество частиц в системе. Уравнение состояния не дает нам всех термодинамических параметров системы. Мы можем взять уравнение для Энергия Гельмгольца А [24]
Из уравнения, полученного выше для lnQ, мы нашли
Где Φ - неопределенная константа, которую можно взять из Уравнение Сакура – Тетрода чтобы идеальный газ был:
Это уравнение выражает А с точки зрения его естественные переменные V и Т , и поэтому дает нам всю термодинамическую информацию о системе. Механическое уравнение состояния уже было выведено выше.
Энтропийное уравнение состояния дает энтропия (S )
из которого мы можем вычислить внутренняя энергия
Аналогичные уравнения можно записать для других термодинамический потенциал и химический потенциал, но выражающий любой потенциал как функцию давления п потребует решения полинома третьего порядка, что дает сложное выражение. Таким образом, выражая энтальпия и Энергия Гиббса как функции их естественных переменных будут сложными.
Уменьшенная форма
Хотя материальная постоянная а и б в обычной форме уравнения Ван-дер-Ваальса отличается для каждой рассматриваемой жидкости, уравнение может быть преобразовано в инвариантную форму, применимую к все жидкости.
Определение следующих сокращенных переменных (жр, жC редуцированные и критическая переменная версии ж, соответственно),
- ,
куда
как показано Зальцманом.[25]
Приведенная выше первая форма уравнения состояния Ван-дер-Ваальса может быть преобразована в следующую сокращенную форму:
- )
Это уравнение инвариантный для всех жидкостей; то есть применяется одно и то же уравнение состояния в приведенной форме, независимо от того, а и б может быть для конкретной жидкости.
Эту инвариантность также можно понять в терминах принципа соответствующих состояний. Если две жидкости имеют одинаковое пониженное давление, уменьшенный объем и пониженную температуру, мы говорим, что их состояния соответствуют. Состояния двух жидкостей могут быть соответствующими, даже если их измеренные давление, объем и температура сильно различаются. Если состояния двух жидкостей соответствуют, они существуют в одном и том же режиме приведенного уравнения состояния. Следовательно, они будут реагировать на изменения примерно одинаково, даже если их измеримые физические характеристики могут значительно отличаться.
Кубическое уравнение
Уравнение Ван-дер-Ваальса представляет собой кубический уравнение состояния; в приведенной формулировке кубическое уравнение имеет вид:
При критической температуре, где мы получаем как ожидалось
За Тр <1, есть 3 значения для vр.За Тр > 1, существует 1 действительное значение для vр.
Решение этого уравнения для случая трех отдельных корней можно найти при Конструкция Максвелла
Применение для сжимаемых жидкостей
Уравнение также можно использовать как PVT уравнение для сжимаемые жидкости (например. полимеры). В таком случае удельный объем изменения небольшие и это можно записать в упрощенном виде:
куда п это давление, V является удельный объем, Т это температура и А, Б, В параметры.
Смотрите также
- Газовые законы
- Идеальный газ
- Температура инверсии
- Итерация
- Конструкция Максвелла
- Настоящий газ
- Теорема о соответствующих состояниях
- Константы Ван-дер-Ваальса (страница данных)
- Уравнение состояния Редлиха – Квонга.
Рекомендации
- ^ а б c d Силби, Роберт Дж .; Олберти, Роберт А .; Бавенди, Мунги Г. (2004). Физическая химия (4-е изд.). Вайли. ISBN 978-0471215042.
- ^ а б c "Дж. Д. Ван дер Ваальс, Уравнение состояния для газов и жидкостей: Нобелевская лекция, 12 декабря 1910 г." (PDF). Нобелевские лекции по физике 1901–1921 гг.. Амстердам: Издательство Elsevier. 1967. С. 254–265. В архиве (PDF) из оригинала 10 апреля 2020 г.
- ^ Эндрюс, Т. (1869). "Бейкерская лекция: о газообразном состоянии вещества". Философские труды Лондонского королевского общества. 159: 575–590. Дои:10.1098 / рстл.1869.0021.
- ^ Кляйн, М. Дж. (1974). «Историческое происхождение уравнения Ван-дер-Ваальса». Physica. 73 (1): 31. Bibcode:1974Phy .... 73 ... 28K. Дои:10.1016/0031-8914(74)90224-9.
- ^ ван дер Ваальс, Дж. Д. (1873). Over de Continuiteit van den Gas- en Vloeistoftoestand [О непрерывности газового и флюидного состояний] (на голландском). Лейденский университет.
- ^ Клерк-Максвелл, Дж. (1874). "Over de Continuiteit van den Gas- en Vloeistofiocstand. Academisch Proefschrift". Природа. 10 (259): 477–480. Bibcode:1874Натура..10..477C. Дои:10.1038 / 010477a0. S2CID 4046639.
- ^ Максвелл, Дж. (1890). "LXIX. Ван дер Ваальс о непрерывности газообразного и жидкого состояний". В Niven, W. D. (ed.). Научные статьи Джеймса Клерка Максвелла, Vol. II. Издательство Кембриджского университета. С. 407–415.
- ^ Чанг, Раймонд (2014). Физическая химия для химических наук. Книги университетских наук. п. 14. ISBN 978-1891389696.
- ^ «Отклонения от поведения идеального газа». Bodner Research Web. Университет Пердью, Научный колледж, Отделение химического образования. 2004 г.
- ^ а б Хьюитт, Найджел. «Кто вообще такой Ван дер Ваальс и какое отношение он имеет к моей заправке найтроксом?». Математика для дайверов.
- ^ а б Линдси, Брайс, «Правила смешивания для простых уравнений состояния», Межмолекулярные потенциалы и оценка второго вириального коэффициента
- ^ а б Хилл, Террелл Л. (2012) [1960]. Введение в статистическую термодинамику. Дуврские книги по физике. Чикаго: Р.Р.Доннелли (Курьер / Дувр). ISBN 978-0486130903.. Обратите внимание, что это издание Доннелли является перепечаткой издания Дувра 1986 года, которое само перепечатало исправленную версию 1962 года оригинального текста 1960 года (Addison Wesley Series in Chemistry, Francis T. Bonner & George C. Pimentel, Eds., Reading, MS: Аддисон-Уэсли).
- ^ Сандлер, С. И. (1999). Химическая и инженерная термодинамика (Третье изд.). Нью-Йорк: Вили. п. 273.
- ^ Аткинс, Питер; де Паула, Хулио (2006). Физическая химия (8-е изд.). Нью-Йорк: Макмиллан. С. 17–22, 104 и далее, 632–641. ISBN 0716787598.
- ^ Берри, Р. Стивен; Райс, Стюарт А .; Росс, Джон (2000). Физическая химия. Оксфорд: Издательство Оксфордского университета. стр.298–306 и пассим. ISBN 0195105893.
- ^ Dill, Ken A .; Бромберг, Сарина (2003). Молекулярные движущие силы: статистическая термодинамика в химии и биологии. Нью-Йорк: Наука о гирляндах. стр.457–462. ISBN 0815320515.
- ^ Хилл, Террелл Л. (1960). Введение в статистическую термодинамику. Курьерская корпорация. п. 77.
- ^ Денкер, Джон (2014). «Глава 26.9, Вывод: частица в ящике». Современная термодинамика. Независимая издательская платформа CreateSpace. ISBN 978-1502530356.
- ^ а б c Сэндлер, Стэнли И. (2006). Химическая, биохимическая и инженерная термодинамика (4-е изд.). Нью-Йорк: Джон Вили и сыновья. п.284. ISBN 978-0-471-66174-0.
- ^ Сандлер (2006), стр. 287.
- ^ Клерк-Максвелл, Дж. (1875 г.). «О динамических доказательствах молекулярной конституции тел». Природа. 11 (279): 357–359. Bibcode:1875Натура .. 11..357С. Дои:10.1038 / 011357a0. ISSN 0028-0836.
- ^ Максвелл (1890), «LXXI. О динамических доказательствах молекулярного строения тел», стр. 418–438.
- ^ Elhassan, A.E .; Craven, R.J.B .; де Реук, К. М. (1997). «Метод площадей для чистых жидкостей и анализ двухфазной области». Равновесия жидкой фазы. 130 (1–2): 167–187. Дои:10.1016 / S0378-3812 (96) 03222-0.
- ^ Гершенсон, Майкл (нет данных), «Лекция 16. Газ Ван-дер-Ваальса (гл. 5)» (PDF), Набор слайдов из предыдущего обучения PHYS 351, Теплофизика (статистика и термодинамика), Университет Рутгерса, факультет физики и астрономии, получено 25 июн 2015. Возможно получено из Шредер, Даниэль В. (2013). Введение в теплофизику. Нью-Йорк: образование Пирсона. ISBN 978-1292026213.
- ^ Зальцман, В. Р. (8 июля 2004 г.). «Критические константы газа Ван-дер-Ваальса». Химическая термодинамика. Кафедра астрономии Государственного университета Аризоны. Архивировано из оригинал 29 июля 2015 г.. Получено 7 июля 2015.
дальнейшее чтение
- Чендлер, Дэвид (1987). Введение в современную статистическую механику. Оксфорд: Издательство Оксфордского университета. С. 287–295. ISBN 0195042778.
- Крест, Майкл (2004), «Лекция 3: Фазовые переходы первого порядка» (PDF), Физика 127: Статистическая физика, второй семестр, Пасадена, Калифорния: Отделение физики, математики и астрономии Калифорнийского технологического института..
- Dalgarno, A .; Дэвисон, ВД (1966). «Расчет ван-дер-ваальсовых взаимодействий». Успехи атомной и молекулярной физики. 2: 1–32. Дои:10.1016 / S0065-2199 (08) 60216-X. ISBN 9780120038022.
- Киттель, Чарльз; Кремер, Герберт (1980). Теплофизика (Пересмотренная ред.). Нью-Йорк: Макмиллан. С. 287–295. ISBN 0716710889.





















































![A (T, V, N) = - NkT left [1+ ln left ({ frac {(V-Nb ') T ^ {3/2}} {N Phi}} right) right ] - { frac {a'N ^ {2}} {V}}.](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee0772e1591ec074c94d8ec125ac5fc2b927d375)


![{ Displaystyle S = - left ({ frac { partial A} { partial T}} right) _ {N, V} = Nk left [ ln left ({ frac {(V-Nb ') T ^ {3/2}} {N Phi}} right) + { frac {5} {2}} right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d26d016c00d464ed8d30641b9c650e5a61cbc404)







