WikiDer > Азид брома
 | |
| Имена | |
|---|---|
| Название ИЮПАК Азид брома | |
| Другие имена Нитрид брома, бромистый азот, азидобромид | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| BrN3 | |
| Молярная масса | 121,924 г / моль |
| Внешность | Красная жидкость |
| Плотность | Нет данных |
| Температура плавления | -45 градусов C (-49 F °) |
| Точка кипения | Взрывается |
| Структура[1] | |
| четырехугольный | |
| я4CD | |
Формула единиц (Z) | 16 |
| Опасности | |
| Главный опасности | Это яд которые могут самопроизвольно взорваться.[2] Взрывается при контакте с мышьяком, натрием, серебряной фольгой или фосфором. Имеет класс опасности 1,1А. |
| Родственные соединения | |
Родственные соединения | Азид фтора Азид хлора Азид йода Гидразойная кислота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
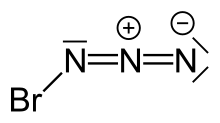
Азид брома это взрывчатое вещество неорганическое соединение с формулой BrN3. Он был описан как кристалл или красная жидкость при комнатной температуре.[нужна цитата] Он чрезвычайно чувствителен к небольшим колебаниям температуры и давления, взрывы происходят при Δp ≥ 0,05. Торр а также при кристаллизации, поэтому при работе с этим реагентом необходимо соблюдать особую осторожность.
Подготовка
Азид брома может быть получен реакцией азид натрия с Br2. В этой реакции образуется азид брома и бромид натрия:[1]
- NaN3 + Br2 → BrN3 + NaBr
Структура
Высокая чувствительность азида брома привела к трудностям в распознавании его кристаллической структуры. Несмотря на это, кристаллическая структура азида брома была получена с помощью миниатюрного зонная плавка процедура с целенаправленным инфракрасный лазер радиация. В отличие от В3, который при кристаллизации образует бесконечную цепочечную структуру, BrN3 образует спиралевидную структуру. Каждая молекула принимает транс-согнутый структура, которая также находится в газовой фазе.[1]
Реакции
Азид брома присоединяется к алкены как через ионный и свободнорадикальное присоединение, каждая из которых дает противоположную ориентацию в продуктах. Ионное присоединение происходит стереоспецифично в пер.[3]С реакциями с участием азида брома сложно работать. Молекула очень реактивна и, как известно, легко взрывается. Это делает его ключевым реагентом во взрывчатых веществах.[4] Фотохимия эксперименты с азидом брома показали, что УФ фотолиз небольшого образца азида брома привел к диссоциации всего образца, что сделало его нестабильным. Подобные образцы с молекулами азидов такого эффекта не показали. Это показывает нестабильную тенденцию азида брома в том, что даже в присутствии солнечного света азид брома будет реактивной молекулой.[5]
Безопасность
При обращении с азидом брома необходимо проявлять особую осторожность, поскольку он потенциально токсичен и может взорваться в различных условиях. Концентрированные растворы в органических растворителях также могут взорваться. Жидкость взрывается при контакте с мышьяк, натрий, Серебряная фольга, или же фосфор. При нагревании до разложения выделяет высокотоксичные пары брома и взрывается. Количество соединения, используемого во время экспериментов, должно быть ограничено до 2 ммоль. Он также представляет потенциально умеренную опасность возгорания в виде пара в результате химической реакции. Также это мощный окислитель.[1]
Запрещен транспорт в Соединенные Штаты посредством Министерство транспорта США.
Рекомендации
- ^ а б c d Lyhs, Бенджамин; Блазер, Дитер; Вельпер, Кристоф; Шульц, Стефан; Янсен, Георг (20 февраля 2012 г.). «Твердотельная структура азида брома». Angewandte Chemie International Edition. 51 (8): 1970–1974. Дои:10.1002 / anie.201108092. PMID 22250068.
- ^ Патнаик, Прадёт (2007). Всеобъемлющее руководство по опасным свойствам химических веществ. 615: Wiley-Interscience. п. 615. ISBN 0-471-71458-5.CS1 maint: location (связь)
- ^ Лю, Роберт (1968). «2,3-Бис (перфторметил) бицикло2.2.2] окта-2,5,7-триены и реакции их фотореорганизации». Варенье. Chem. Soc. 90 (1): 215–216. Дои:10.1021 / ja01003a041.
- ^ Перри, Дейл Л., изд. (1995). Справочник неорганических соединений. Бока-Ратон: CRC Press. п. 74. ISBN 0-8493-8671-3.
- ^ Henshaw, T. L .; Дэвид, С. Дж .; MacDonald, M.A .; Gilbert, J. V .; Стедман, Д. Х .; Кумб, Р. Д. (1987). «Столкновительное разложение азида брома». J. Phys. Chem. 91 (9): 2287–2293. Дои:10.1021 / j100293a016.
| HN3 | Он | ||||||||||||||||||
| LiN3 | Бен3)2 | B (N3)3 | CH3N3, C (N3)4 | N (N3)3,ЧАС2N — N3 | О | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Si (N3)4 | п | ТАК2(N3)2 | ClN3 | Ar | ||||||||||||
| КН3 | Может3)2 | Sc (N3)3 | Банка3)4 | VO (N3)3 | Cr (N3)3, CrO2(N3)2 | Mn (N3)2 | Fe (N3)2, Fe (N3)3 | Против3)2, Против3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | В качестве | Se (N3)4 | BrN3 | Kr | ||
| Руб.3 | Sr (N3)2 | Y | Zr (N3)4 | Nb | Пн | Tc | Пробег3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (N3)2 | В | Sn | Sb | Te | В3 | Xe (N3)2 | ||
| CsN3 | Ba (N3)2 | Hf | Та | W | Re | Операционные системы | Ir (N3)63− | Pt (N3)62− | Au (N3)4− | Hg2(N3)2, Hg (N3)2 | TlN3 | Pb (N3)2 | Би (N3)3 | По | В | Rn | |||
| Пт | Ra (N3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла | Ce (N3)3, Ce (N3)4 | Pr | Nd | Вечера | См | Европа | Gd (N3)3 | Tb | Dy | Хо | Э | Тм | Yb | Лу | |||||
| Ac | Чт | Па | UO2(N3)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||