WikiDer > Литий амид
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Литий амид | |
| Другие имена Литамид | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.062 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
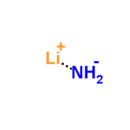
| LiNH 2 | |
| Молярная масса | 22,96 г / моль |
| Внешность | белое твердое вещество |
| Плотность | 1,178 г / см3 |
| Температура плавления | 375 ° С (707 ° F, 648 К) |
| Точка кипения | 430 ° С (806 ° F, 703 К) разлагается |
| реагирует | |
| Растворимость | слабо растворим в этиловый спирт не растворим в аммиак |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -182 кДж / моль |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
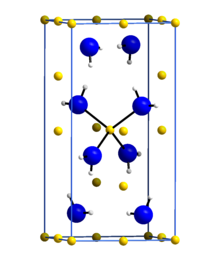
Литий амид или же азанид лития является неорганическое соединение с химической формулой LiNH2. Это белое твердое вещество с тетрагональной кристаллической структурой. Амид лития можно получить путем обработки литий металл с жидкостью аммиак:[1]
- 2Li + 2NH3 → 2ЛиНХ2 + H2
Другие амиды лития
Сопряженные основания аминов известны как амиды. Таким образом, амид лития может также относиться к любому соединению в классе литиевой соли амин. Эти соединения имеют общий вид Li
- 2Li + 2R2NH → 2LiNR2 + H2
Амиды лития - очень реактивные соединения. Конкретно они сильные базы.
Примеры
Тетраметилпиперидид лития кристаллизовался в виде тетрамера.[2] С другой стороны, литиевое производное бис (1-фенилэтил) амина кристаллизуется как тример:[3]
Также возможно приготовление смешанных олигомеров металлов алкоксиды и амиды.[4] Они связаны с супербазы которые представляют собой смеси алкоксидов металлов и алкилов. Циклические олигомеры образуются, когда азот амида образует сигма-облигация к литию, а азот одинокая пара связывается с другим металлическим центром.
Другие литийорганические соединения (такие как BuLi) обычно считается существующим и функционирующим через агрегированные виды высокого порядка.
Смотрите также
Рекомендации
- ^ П. В. Шенк (1963). «Амид лития». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд.. 1. Нью-Йорк, Нью-Йорк: Academic Press. п. 454.
- ^ М.Ф. Лапперт; М.Дж. Слейд; А. Сингх; Дж. Л. Этвуд; Р. Д. Роджерс; Р. Шакир (1983). «Структура и реакционная способность стерически затрудненных амидов лития и их диэтилэфиратов: кристаллические и молекулярные структуры [Li {N (SiMe3)2} (OEt2)]2 и тетракис (2,2,6,6-тетраметилпиперидинатолитий) ». Журнал Американского химического общества. 105 (2): 302–304. Дои:10.1021 / ja00340a031.
- ^ D.R. Армстронг; К.В. Хендерсон; A.R. Кеннеди; W.J. Kerr; Ф.С. Mair; J.H. Мойр; P.H. Моран; Р. Снайт (1999). "Структурные исследования хиральных амидов лития [{PhC (H) Me}2NLi] и [PhCH2{PhC (H) Me} NLi · THF], полученный из α-метилбензиламина ». Dalton Transactions: 4063–4068. Дои:10.1039 / A904725E.
- ^ К.В. Хендерсон, Д.С. Вальтер и П.Г. Уильямс (1995). «Идентификация униметаллического комплекса оснований по 6Li ЯМР-спектроскопия и анализ монокристаллов ». Журнал Американского химического общества. 117 (33): 8680–8681. Дои:10.1021 / ja00138a030.
- Индекс Merck, 11-е издание, 5398.


