WikiDer > N-бутиллитий
| |||
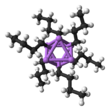
 Крупным планом делокализованные связи между бутилом и литием | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК бутиллитий, тетра-μ3-бутил-тетралитий | |||
| Другие имена NBL, BuLi, 1-литиобутан | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.363 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС9Ли | |||
| Молярная масса | 64.06 г · моль−1 | ||
| Внешность | бесцветная жидкость неустойчивый обычно получается как решение | ||
| Плотность | 0,68 г / см3, определяется растворителем | ||
| Температура плавления | -76 ° С (-105 ° F, 197 К) (<273 К) | ||
| Точка кипения | разлагается | ||
| Реакция | |||
| Растворимость | Диэтиловый эфир, циклогексан | ||
| Кислотность (пKа) | 50 [1] | ||
| Структура | |||
| тетрамерный раствор | |||
| 0 D | |||
| Опасности | |||
| Главный опасности | пирофорный (самовозгорается на воздухе), разлагается до коррозионного LiOH | ||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Связанный литийорганический реагенты | сек-бутиллитий терт-бутиллитий гексиллитий метиллитий | ||
Родственные соединения | гидроксид лития | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
п-Бутиллитий (сокращенно п-BuLi) является литийорганический реагент. Он широко используется как полимеризация инициатор производства эластомеры такие как полибутадиен или стирол-бутадиен-стирол (SBS). Кроме того, он широко используется в качестве сильного основание (супербаза) в синтез органических соединений как в фармацевтической промышленности.
Бутиллитий коммерчески доступен в виде растворов (15%, 25%, 1,5 М, 2 М, 2,5 М, 10 М и т. Д.) В алканы такие как пентан, гексаны, и гептаны. Решения в диэтиловый эфир и THF можно приготовить, но они недостаточно стабильны для хранения. Ежегодное мировое производство и потребление бутиллития и других литийорганических соединений оценивается в 2000–3000 тонн.[2]
Хотя бутиллитий бесцветен, н-бутиллитий обычно встречается в алканах в виде бледно-желтого раствора. Такие растворы стабильны бесконечно при правильном хранении.[3] но на практике они деградируют с возрастом. Белый мелкий осадок (гидроксид лития) откладывается, и цвет меняется на оранжевый.[3][4]
Структура и склеивание
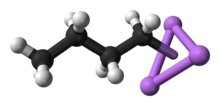
п-BuLi существует в виде кластера как в твердом состоянии, так и в растворе. Склонность к агрегированию характерна для литийорганических соединений. Агрегаты удерживаются вместе делокализованными ковалентными связями между литием и концевым углеродом бутильной цепи.[5] На случай, если п-BuLi, кластеры бывают тетрамерными (в эфире) или гексамерными (в циклогексан). Кластер искаженный кластер кубанового типа с Ли и CЧАС2Группы R в чередующихся вершинах. Эквивалентное описание описывает тетрамер как Li4 тетраэдр пересекаются с тетраэдром [CЧАС2Р]4. Связь внутри кластера связана с тем, что используется для описания диборана, но более сложна, поскольку задействовано восемь атомов. Отражая его "электронодефицитный характер", п-бутиллитий очень реактивен по отношению к Базы Льюиса.
Из-за большой разницы между электроотрицательность из углерод (2.55) и литий (0.98) связь C-Li сильно поляризована. Разделение зарядов оценивается в 55-95%. Для практических целей n-BuLi часто можно рассматривать как реагирующий как бутиловый анион, п-Bu−, и литий катион, Ли+.
Подготовка
Стандартная подготовка к п-BuLi - реакция 1-бромбутан или 1-хлорбутан с металлом Li:[3]
- 2 Li + C4ЧАС9X → C4ЧАС9Li + LiX
- где X = Cl, Br
Если литий, используемый для этой реакции, содержит 1–3% натрий, реакция протекает быстрее, чем при использовании чистого лития. Растворители, используемые для этого препарата, включают: бензол, циклогексан и диэтиловый эфир. Когда BuBr является предшественником, продукт представляет собой гомогенный раствор, состоящий из смешанного кластера, содержащего как LiBr, так и BuLi, вместе с небольшим количеством октан. BuLi образует более слабый комплекс с LiCl, так что реакция BuCl с Li дает осадок LiCl.
Растворы бутиллития, которые подвержены разложению на воздухе, стандартизированы титрование. Популярная слабая кислота - это бифенил-4-метанол, который дает в конечной точке сильно окрашенное дилитиопроизводное.[6]
Приложения
Бутиллитий в первую очередь ценится как инициатор анионного полимеризация из диены, такие как бутадиен.[7] Реакция называется «карболитированием»:
- C4ЧАС9Li + CH2= СН-СН = СН2 → С4ЧАС9-CH2-CH = CH-CH2Ли
Изопрен могут быть стереоспецифически полимеризованы таким образом. Также коммерческое значение имеет использование бутиллития для производства стирол-бутадиен полимеры. Четное этилен вставит в BuLi.[8]
Реакции
Бутиллитий - сильное основание (pKа ≈ 50), но это еще и мощный нуклеофил и восстановитель, в зависимости от других реагентов. Кроме того, помимо того, что n-BuLi является сильным нуклеофилом, он связывается с апротонными основаниями Льюиса, такими как простые эфиры и третичные амины, которые частично дезагрегируют кластеры, связываясь с литиевыми центрами. Его использование в качестве сильного основание упоминается как металлизация. Реакции обычно проводят в тетрагидрофуран и диэтиловый эфир, которые являются хорошими растворителями для образующихся литийорганических производных (см. ниже).
Металлизация
Одно из самых полезных химических свойств п-BuLi - это его способность депротонировать широкий спектр слабых Кислоты Бренстеда. т-Бутиллитий и s-бутиллитий более основные. п-BuLi может депротонировать (то есть металат) многие типы связей C-H, особенно там, где сопряженное основание стабилизируется электроном делокализация или один или несколько гетероатомов (неуглеродных атомов). Примеры включают ацетилены (ЧАС-CC-R), метилсульфиды (ЧАС-CH2SR), тиоацетали (ЧАС-CH (SR)2, например Дитиан), метилфосфины (ЧАС-CH2PR2), фураны, тиофены и ферроцен (Fe (ЧАС-C5ЧАС4) (C5ЧАС5)).[9] В дополнение к этому, он также будет депротонировать все более кислотные соединения, такие как спирты, амины, энолизируемый карбонильные соединения и любые явно кислые соединения для получения алкоксидов, амидов, енолятов и других -атов лития соответственно. Стабильность и непостоянство из бутан в результате таких депротонирование реакции удобны, но также могут быть проблемой для крупномасштабных реакций из-за объема производимого горючего газа.
- LiC4ЧАС9 + R-H → C4ЧАС10 + Р-Ли
Кинетическая основность п-BuLi зависит от растворителя или сорастворителя. Лиганды, входящие в комплекс Li+ такие как тетрагидрофуран (THF), тетраметилэтилендиамин (TMEDA), гексаметилфосфорамид (HMPA) и 1,4-диазабицикло [2.2.2] октан (DABCO) дополнительно поляризуют связь Li-C и ускоряют металлирование. Такие добавки также могут способствовать выделению литиированного продукта, известным примером которого является дилитиоферроцен.
- Fe (C5ЧАС5)2 + 2 LiC4ЧАС9 + 2 TMEDA → 2 C4ЧАС10 + Fe (C5ЧАС4Ли)2(TMEDA)2
База Шлоссера это супербаза производится обработкой бутиллития трет-бутоксид калия. Он кинетически более реактивен, чем бутиллитий, и часто используется для решения сложных задач. металлоконструкции. Анион бутоксида образует комплекс с литием и эффективно производит бутилкалий, который является более активным, чем соответствующий литиевый реагент.
Примером использования н-бутиллития в качестве основания является добавление амина к метилкарбонату с образованием метилового эфира. карбамат, где н-бутиллитий служит для депротонирования амина:
- н-BuLi + R2NH + (MeO)2CO → R2N-CO2Me + LiOMe + BuH
Галоген-литиевый обмен
Бутиллитий реагирует с некоторыми органическими бромидами и иодидами в реакции обмена с образованием соответствующего литийорганического производного. Реакция обычно не проходит с органическими хлоридами и фторидами:
- C4ЧАС9Li + RX → C4ЧАС9Х + RLi (Х = Br, I)
Эта реакция полезна для получения нескольких типов соединений RLi, в частности ариллитий и некоторые виниллитиевые реагенты. Однако полезность этого метода значительно ограничена наличием в реакционной смеси n-BuBr или n-BuI, которые могут реагировать с образующимся реагентом RLi, и конкурирующими дегидрогалогенирование реакции, в которых n-BuLi служит основанием:
- 2 С4ЧАС9Br + RLi → 2 С4ЧАС9R + LiBr
- 2 С4ЧАС9Li + R'CH = CHBr → 2 С4ЧАС10 + R'C≡CLi + LiBr
Эти побочные реакции для RI значительно менее важны, чем для RBr, поскольку обмен йода на литий на несколько порядков быстрее, чем обмен бром-литий. По этим причинам предпочтительными субстратами являются арил, винил и первичные алкилйодиды, и т-БуЛи обычно используется вместо n-BuLi, поскольку образовавшийся t-BuI немедленно разрушается t-BuLi в реакции дегидрогалогенирования (таким образом, требуется 2 эквивалента t-BuLi). Альтернативно, реагенты на основе виниллития могут быть получены путем прямой реакции винилгалогенида (например, циклогексенилхлорида) с литием или путем обмена олово-литий (см. Следующий раздел).[3]
Трансметалляции
Родственное семейство реакций - это трансметалляции, в котором два металлоорганических соединения обмениваются своими металлами. Многие примеры таких реакций включают обмен Li с Sn:
- C4ЧАС9Ли + я3SnAr → C4ЧАС9SnMe3 + LiAr
- где Ar - арил, Me - метил
Реакции обмена олово-литий имеют одно главное преимущество перед обменами галоген-литий для получения литийорганических реагентов в том, что получаемые соединения олова (C4ЧАС9SnMe3 в приведенном выше примере) гораздо менее реакционноспособны по отношению к литиевым реагентам, чем галогенидные продукты соответствующих галоген-литиевых обменов (C4ЧАС9Br или C4ЧАС9Cl). Другой металлы и металлоиды которые претерпевают такие реакции обмена, являются органическими соединениями Меркурий, селен, и теллур.
Карбонильные добавки
Литийорганические реагенты, в том числе п-BuLi используются в синтезе специфических альдегиды и кетоны. Одним из таких синтетических путей является реакция литийорганического реагента с двузамещенным амиды:
- р1Li + R2CONMe2 → LiNMe2 + R2C (O) R1
Разложение THF
ТГФ депротонируется бутиллитием, особенно в присутствии TMEDA, потерей одного из четырех протонов, соседних с кислородом. Этот процесс, при котором для производства бутана потребляется бутиллитий, вызывает обратный циклоприсоединение дать енолят ацетальдегид и этилен.[10] Следовательно, реакции BuLi в ТГФ обычно проводят при низких температурах, таких как –78 ° C, как это обычно происходит с помощью морозильная ванна из сухой лед/ацетон. Также используются более высокие температуры (−25 ° C или даже −15 ° C).
Термическое разложение
При нагревании п-BuLi, аналогично другим алкиллитиевым реагентам с «β-атомами водорода», подвергается устранение β-гидрида производить 1-бутен и гидрид лития (LiH):
- C4ЧАС9Li → LiH + CH3CH2CH = CH2
Безопасность
Алкиллитиевые соединения хранятся в атмосфере инертного газа для предотвращения потери активности и из соображений безопасности. п-BuLi бурно реагирует с водой:
- C4ЧАС9Li + H2О → С4ЧАС10 + LiOH
Это экзэргоническая реакция. Если кислород присутствует, бутан вступит в реакцию с кислородом и воспламенится.
BuLi также реагирует с CO2 дать пентаноат лития:
- C4ЧАС9Li + CO2 → С4ЧАС9CO2Ли
Смотрите также
- Пропиниллитий, металлоорганическое соединение.
Рекомендации
- ^ Бернье, Дэвид. «Некоторые полезные значения pKa». Org @ Work. Архивировано из оригинал 9 мая 2017 г.. Получено 26 мая 2017.
- ^ Швиндеман, Джеймс А. (1 августа 2014 г.). «Приготовление, свойства и безопасное обращение с коммерческими литийорганическими соединениями: алкиллитием, втор-органоамидами лития и алкоксидами лития». Исследования и разработки в области органических процессов. 18 (10): 1192–1210. Дои:10.1021 / op500161b.
- ^ а б c d Brandsma, L .; Verkruijsse, Х. Д. (1987). Препаративная полярная металлорганическая химия I. Берлин: Springer-Verlag. ISBN 3-540-16916-4..
- ^ http://www.sigmaaldrich.com/catalog/product/fluka/20160?lang=en®ion=GB
- ^ Эльшенбройх, К. «Металлоорганические соединения» (2006) Wiley-VCH: Weinheim. ISBN 3-527-29390-6.
- ^ Juaristi, E .; Martínez-Richa, A .; García-Rivera, A .; Крус-Санчес, Дж. С. (1983). «Использование 4-бифенилметанола, 4-бифенилуксусной кислоты и 4-бифенилкарбоновой кислоты / трифенилметана в качестве индикаторов при титровании алкилов лития. Изучение дианиона 4-бифенилметанола». Журнал органической химии. 48 (15): 2603–2606. Дои:10.1021 / jo00163a038.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Ульрих Вительманн и Ричард Дж. Бауэр «Литий и литиевые соединения» в Энциклопедии промышленной химии Ульмана, 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a15_393.
- ^ Делани, М. С. (20 января 1991 г.). «Скорость полимеризации этилена, инициированной различными хелатирующими комплексами третичный диамин: н-бутиллитиевые комплексы». Прикладной полимер. 42 (2): 533–541. Дои:10.1002 / app.1991.070420226.
- ^ Sanders, R .; Мюллер-Вестерхофф, У. Т. (1996). «Литиация ферроцена и рутеноцена - ретракция и улучшение». Журнал металлоорганической химии. 512 (1–2): 219–224. Дои:10.1016 / 0022-328X (95) 05914-B.
- ^ Клейден, Джонатан; Ясин, Самрин А. (11.02.2002). «Пути разложения THF литийорганическими соединениями: роль HMPA». Новый журнал химии. 26 (2): 191–192. Дои:10.1039 / B109604D. ISSN 1369-9261.
дальнейшее чтение
- Листы продукции производителя лития FMC
- Справочник экологической химии
- Вайссенбахер, Андерсон, Исикава, Металлоорганические соединения, Июль 1998 г., стр. 681.7002, Справочник по экономике химических веществ SRI International
- План тестирования на ВПЧ, представленный FMC Lithium в EPA
- Оваска, Т.В. e-EROS Энциклопедия реагентов для органического синтеза «н-бутиллитий». Уайли и сыновья. 2006 г. Дои:10.1002 / 047084289X.rb395
- Greenwood, N. N .; Эрншоу, А. Химия элементов, 2-е изд. 1997: Баттерворт-Хайнеманн, Бостон.