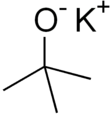WikiDer > Трет-бутоксид калия
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК 2-метилпропан-2-олат калия | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.011.583 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС9КО | |||
| Молярная масса | 112,21 г моль−1 | ||
| Внешность | твердый | ||
| Температура плавления | 256 ° С (493 ° F, 529 К) | ||
| Растворимость в диэтиловый эфир | 4,34 г / 100 г (25-26 ° С)[1] | ||
| Растворимость в Гексан | 0,27 г / 100 г (25-26 ° С)[1] | ||
| Растворимость в Толуол | 2,27 г / 100 г (25-26 ° С)[1] | ||
| Растворимость в THF | 25,00 г / 100 г (25-26 ° С)[1] | ||
| Опасности | |||
| Паспорт безопасности | Оксфордский паспорт безопасности материалов | ||
Классификация ЕС (DSD) (устарело) | Вредный (Xn), Едкий (C) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
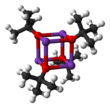
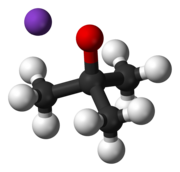
Калий терт-бутоксид это химическое соединение с формула K+(CH3)3CO−. Это бесцветное твердое вещество является прочным основание (pKa конъюгированной кислоты около 17), что полезно в органический синтез. Он существует как тетрамерный кластер кубанового типа. В химической литературе его часто называют калием. т-бутоксид. Соединение часто изображают как соль, и оно часто ведет себя соответствующим образом, но не ионизируется в растворе.
Подготовка
Калий т-бутоксид коммерчески доступен в виде раствора и твердого вещества, но часто образуется на месте для лабораторного использования, потому что образцы очень чувствительны, а старые образцы часто бывают низкого качества. Его получают по реакции сухого терт-бутиловый спирт с калий металл.[2] Твердое вещество получают испарением этих растворов с последующим нагреванием твердого вещества. Твердое вещество можно очистить сублимацией при 220 ° C и 1 мм рт. Сублимация также может происходить при 140 ° C и 0,01 гПа. Желательно покрыть сырье стекловатой, так как трет-бутанолат калия имеет тенденцию «подпрыгивать», поэтому части могут быть выброшены во время сублимации. Удаление безводных с использованием инертного сублимационного аппарата особенно выгодно.
Структура
Калий терт-бутоксид кристаллизуется из тетрагидрофуран/пентан при -20 ° C как [tBuOK · tBuOH]∞, состоящий из бесконечных одномерных цепочек, связанных между собой водородная связь. Сублимация [tBuOK · tBuOH]∞ дает тетрамер [tBuOK]4, который имеет кубаноподобную структуру. Незначительный Льюис Бэйсик растворители, такие как ТГФ и диэтиловый эфир не разрушают тетрамерную структуру, которая сохраняется в твердом состоянии, в растворе и даже в газовой фазе.[3]
Приложения
В терт-бутоксидные соединения сами по себе полезны в качестве сильного ненуклеофильного основания в органической химии.[4] Он не так силен, как амидные основания, например диизопропиламид лития, но сильнее гидроксида калия. Его стерическая масса препятствует участию группы в нуклеофильном присоединении, таком как Синтез эфира Вильямсона или SN2 реакция. Субстраты, депротонированные калием т-бутоксиды включают терминальные ацетилены и активные метиленовые соединения. Это полезно в дегидрогалогенирование реакции.
Калий терт-бутоксид катализирует реакцию гидросиланы и гетероциклические соединения с образованием силильных производных с высвобождением H2.[5]
Модификации
Сообщалось о многих модификациях, которые влияют на реактивность этого реагента. Соединение имеет сложную кластерную структуру (рисунок рядом - упрощенный рисунок), а добавки, которые модифицируют кластер, влияют на реактивность реагента. Например, DMF, ДМСО, гексаметилфосфорамид (HMPA) и 18-крон-6 взаимодействуют с калиевым центром, повышая основность бутоксида. База Шлоссера, смесь алкоксида и алкиллитиевого соединения, является родственным, но более сильным основанием.[4]
Реакции
Калий терт-бутоксид реагирует с хлороформом с образованием дихлоркарбен,[6] реакция может привести к возгоранию.[7] Калий терт-бутоксид никогда не следует добавлять в дихлорметан.[8]
В качестве основания трет-бутоксид калия может извлекать бета-протон и образовывать продукт Гофмана через реакция элиминации. Эта реакция имеет высокую синтетическую ценность, поскольку может инициировать дальнейшие реакции образующихся алкен, особенно региохимические реакции.
Родственные соединения
Рекомендации
- ^ а б c d Кейн Д. (2006). «Калийтерт-бутоксид». Трет-бутоксид калия. Энциклопедия реагентов для органического синтеза e-EROS. Дои:10.1002 / 047084289X.rp198.pub2. ISBN 0471936235.
- ^ Уильям С. Джонсон и Уильям П. Шнайдер (1963). «β-Карбетокси-γ, γ-дифенилвинилуксусная кислота». Органический синтез.; Коллективный объем, 4, п. 132
- ^ Chisholm, Malcolm H .; Дрейк, Саймон Р .; Naiini, Ahmad A .; Стрейб, Уильям Э. (1991). «Синтез и рентгеновские кристаллические структуры одномерных ленточных цепочек [MOBuт· БутОЙ]∞ и кубаны [MOBuт]4 (M = K и Rb) ". Многогранник. 10 (3): 337–345. Дои:10.1016 / S0277-5387 (00) 80154-0.
- ^ а б Друри Кейн «Т-бутоксид калия» в Энциклопедии реагентов для органического синтеза, Джон Уайли и сыновья, Нью-Йорк, 2006. Дои: 10.1002 / 047084289X.rp198.pub2. Дата публикации статьи в Интернете: 15 сентября 2006 г.
- ^ Антон А. Тоутов, Вен-Бо Лю, Керри Н. Бец, Алексей Федоров, Брайан Штольц, Роберт Х. Граббс (2015). «Силилирование связей C – H в ароматических гетероциклах с помощью металлического катализатора с избытком Земли» (PDF). Природа. 518 (7537): 80–84. Дои:10.1038 / природа14126. PMID 25652999. S2CID 3117834.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Браун, Уильям; Фут, Кристофер; Айверсон, Брент; Анслин, Эрик (10 января 2008 г.). Органическая химия. Cengage Learning. ISBN 978-0495388579.
- ^ Маргарет-Энн Армор (2016-04-19). Руководство по утилизации опасных лабораторных химикатов, третье издание. CRC Press. ISBN 9781420032383.
- ^ Фоден, Чарльз Р .; Уэдделл, Джек Л. (1991-12-29). Опасные материалы: данные о действиях в чрезвычайных ситуациях. CRC Press. ISBN 9780873715980.