WikiDer > Трет-бутоксид натрия
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-метилпропан-2-олат натрия | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.011.584 |
PubChem CID | |
| |
| |
| Характеристики | |
| C4ЧАС9NaО | |
| Молярная масса | 96.105 г · моль−1 |
| Плотность | 1,025 г / см3 |
| Кислотность (пKа) | 19[1] |
| Опасности | |
| Паспорт безопасности | [1] |
| точка возгорания | 14 ° С (57 ° F, 287 К) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Натрий терт-бутоксид это химическое соединение с формула (CH3)3CONa.[2] Это сильный основание и ненуклеофильное основание. Он легко воспламеняется и чувствителен к влаге. В химической литературе он иногда обозначается как натрий. т-бутоксид. По реактивности он похож на более распространенный калий терт-бутоксид.
Соединение можно получить путем обработки терт-бутиловый спирт с гидрид натрия.[3]
Реакции
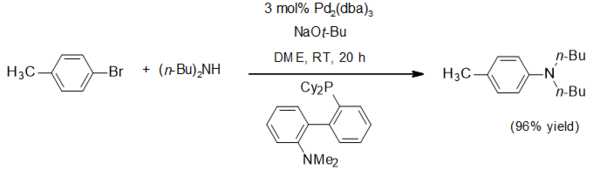
Одно приложение для натрия терт-бутоксид является ненуклеофильным основанием. Он широко использовался в Аминирование Бухвальда – Хартвига, как в этом типичном примере[4]:
Трет-бутоксид натрия используется для получения трет-бутоксидных комплексов. Например гекса (трет-бутокси) дитольфрам (III) таким образом превращается реакцией метатезиса солей из гептахлорида дивольфрама:[5]
- NaW2Cl7(thf)5 + 6 NaOBu-t → W2(OBu-t)6 + 7 NaCl + 7 thf
Структура
Натрий терт-бутоксид образует кластеры в твердом состоянии, оба гексамера[6] и нонамеры.[7]
 |  |
Родственные соединения
Рекомендации
- ^ Дьюик, Пол М. (2013-03-20). Основы органической химии: для студентов факультетов фармацевтики, медицинской химии и биологической химии.. ISBN 9781118681961.
- ^ http://www.sigmaaldrich.com/catalog/ProductDetail.do?lang=en&N4=359270%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC}
- ^ ВЕЧЕРА. Дьюик, 2013. Основы органической химии: для студентов, изучающих фармацевтику, медицинскую химию и биологическую химию. Джон Уайли и сыновья; п. 157. ISBN 978-1-118-68196-1
- ^ Ян, Брайант Х .; Бухвальд, Стивен Л. (1999). «Катализируемое палладием аминирование арилгалогенидов и сульфонатов». Журнал металлоорганической химии. 576 (1–2): 125–146. Дои:10.1016 / S0022-328X (98) 01054-7.
- ^ Бродерик, Эрин М .; Браун, Сэмюэл С .; Джонсон, Марк Дж. А. (2014). «Гекса (алкоксиды) димолибдена и вольфрама». Неорганические синтезы. 36: 95–102. Дои:10.1002 / 9781118744994.ch18. ISBN 9781118744994.
- ^ Э. Остренг, Х. Х. Сёнстеби, С. Эйен, О. Нильсен, Х. Фьельвог (2014). «Атомно-послойное осаждение оксидов натрия и калия: оценка прекурсоров и нанесение тонких пленок». Dalton Trans. 43: 16666–16672. Дои:10.1039 / C4DT01930J.CS1 maint: использует параметр авторов (связь)
- ^ Х. Некола, Ф. Ольбрих, У. Беренс (2002). "Кристалл-унд Molekülstrukturen von Lithium- und Natrium-терт‐Бутоксид ». Z. Anorg. Allg. Chem. 628 (9–10): 2067–2070. Дои:10.1002 / 1521-3749 (200209) 628: 9/10 <2067 :: AID-ZAAC2067> 3.0.CO; 2-N.CS1 maint: использует параметр авторов (связь)