WikiDer > Цианил аллила
 | |
 | |
| Имена | |
|---|---|
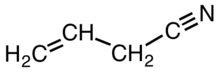
| Систематическое название ИЮПАК 3-бутеннитрил | |
| Идентификаторы | |
3D модель (JSmol) | |
| 605352 | |
| ChemSpider | |
| ECHA InfoCard | 100.003.366 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C4ЧАС5N | |
| Молярная масса | 67.091 г · моль−1 |
| Внешность | бесцветная жидкость |
| Плотность | 0,834 г / см3[1] |
| Температура плавления | -87 ° С (-125 ° F, 186 К) |
| Точка кипения | От 116 до 121 ° C (от 241 до 250 ° F, от 389 до 394 K)[1] |
| Опасности | |
| Главный опасности | Легковоспламеняющийся, яд, раздражает кожу и глаза |
| Паспорт безопасности | MSDS |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H226 H301 H315 H312 H319 H311 | |
| P280 P261 P305 + 351 + 338 P301 + 310 P311 | |
| Проглатывание опасность | Токсично при проглатывании. |
| Вдыхание опасность | Может быть смертельным при вдыхании. Вызывает раздражение дыхательных путей. |
| Глаз опасность | Вызывает раздражение глаз. |
| Кожа опасность | Вызывает раздражение кожи. |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 24 ° С (75 ° F, 297 К)[1] |
| 455 ° С (851 ° F, 728 К)[1] | |
| Родственные соединения | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Цианил аллила является органическое соединение с формулой CH2CHCH2CN. Как и другие малые алкилнитрилы, аллилцианид бесцветен и растворим в органических растворителях. Аллилцианид встречается в природе как антифидант и используется в качестве сшивающего агента в некоторых полимерах.[3]
Синтез
Аллилцианид получают по реакции аллилацетат с цианистым водородом.[3]
Лабораторный способ получения аллилцианида включает лечение аллилбромид с цианид меди (I).[4]
- CH2= CHCH2Br + CuCN → CH2= CHCH2CN + CuBr
Для этой реакции можно использовать другие аллилгалогениды, включая аллилиодид, как это было сделано А. Ринне и Б. Толленсом в 1871 г., где иодид является более удаляемой группой, чем его бромидный эквивалент, и, следовательно, увеличивает выход.[5]
Природные явления
Цианид аллила был открыт в 1863 г. Г. Уиллом и В. Кернером в 1863 г., они обнаружили, что соединение присутствует в горчичное масло.[6] Первый успешный синтез аллилцианида был осуществлен А. Клаусом в 1864 году.[7]
Цианил аллила производится в крестоцветные овощи к мирозиназа, фермент, который гидролизует глюкозинолаты для образования нитрилов и других продуктов.[8] Мирозиназа активируется l-аскорбиновая кислота (витамин C) под влиянием pH,[9] и более высокая активность мирозиназы была показана в поврежденных листьях капусты, в то время как ее активность снижается при варке листьев, хотя глюкозинолаты затем могут быть преобразованы в аллилцианид микрофлорой в кишечнике.[10]Поскольку крестоцветные овощи, такие как капуста, брокколи, цветная капуста и ростки, являются частью рациона человека, аллилцианид обычно употребляется перорально. Нормальная доза аллилцианида, содержащаяся в пище, намного ниже, чем дозы, используемые в исследованиях на животных.[8] Ежедневный уровень, при котором проявлялись поведенческие эффекты, составляет 500 мкг / кг массы тела, тогда как ежедневное потребление человеком составляет 0,12 мкг / кг. Хотя зависимость доза-реакция еще предстоит изучить, поэтому считается, что аллилцианид не обладает активностью как нейротоксикант при потреблении с овощами.
Приложения
Цианид аллила можно использовать в качестве добавки в электролитах на основе пропиленкарбоната для графитовых анодов, предотвращающих расслоение анода за счет образования пленки. Основным механизмом считается механизм восстановительной полимеризации.[11]
Нейротоксичность
Исследования, проведенные на крысах, показали, что аллилцианид вызывает потерю волосковых клеток в слуховой системе и вызывает раздражение роговицы.[12] То же исследование также показало, что рост активности крыс снижается при пероральном приеме аллилцианида. Он имеет эти нейротоксические симптомы, общие с другими алифатическими мононитрилами, такими как 2-бутеннитрил и 3,3’-иминопропионитрил. Также было показано, что цианид аллила вызывает отек аксонов.[13] Исследования, проведенные на мышах, показали, что однократная (хотя и довольно высокая) доза аллилцианида может вызвать необратимые изменения в поведении.[14] Эти изменения включают подергивание головы, повышенную двигательную активность и кружение. Кроме того, было показано, что эти мыши страдают от сокращений нейронов, что может приводить к гибели клеток. Овцы гораздо более терпимы к токсическому воздействию аллилцианида, чем крысы. Исследования показывают, что эта детоксикация связана с предварительным усвоением пищи в рубец.[15]
Токсикокинетика
Известно, что аллилцианид метаболизируется в печени ферментной системой цитохрома P-450 (в основном CYP2E1) до цианида.[16] Абсорбция и распределение аллилцианида у крыс происходит очень быстро. Самые высокие концентрации аллилцианида были измерены в ткани желудка и его содержимом, поскольку желудок является основным местом всасывания после перорального приема. Следующие самые высокие уровни концентрации были обнаружены в костном мозге с пиком концентрации между 0 и 3 часами после введения. В печени, почках, селезенке и легких также накапливался аллилцианид в течение 48 часов. Самая высокая концентрация в почках наблюдалась между 3 и 6 часами после дозирования. Это наблюдение указывает на быстрое удаление аллилцианида. Основной путь детоксикации - это превращение цианида в тиоцианат.[17] Основные пути выведения - через мочу и выдыхаемый воздух.
Считается, что системы серотонина и дофамина участвуют в поведенческих аномалиях, вызванных аллилцианидом. Лечение антагонистами серотонина и дофамина вызвало уменьшение поведенческих аномалий.[18] Атаксия, дрожь, судороги, диарея, слюноотделение, слезотечение и нерегулярное дыхание - известные эффекты, которые вызываются пероральным приемом аллилцианида.
Рекомендации
- ^ а б c d MSDS
- ^ Лиде, Дэвид Р., У. М. Хейнс и Томас Дж. Бруно, ред. CRC Справочник по химии и физике. 93-е изд. Бока-Ратон, Флорида: CRC, 2012. Web. 17 октября 2012 г.
- ^ а б Людгер Крэлинг; Юрген Крей; Джеральд Якобсон; Иоганн Гролиг; Леопольд Микше (2002). «Аллильные соединения». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a01_425.
- ^ Ю. В. Супневский; П. Л. Зальцберг (1928). «Аллилцианид». Орг. Синтезатор. 8: 4. Дои:10.15227 / orgsyn.008.0004.
- ^ А. Ринне, Б. Толленс: "Ueber das Allylcyanür oder Crotonitril", в: Justus Liebigs Annalen der Chemie, 1871, 159 (1), S. 105–109; DOI: 10.1002 / jlac.18711590110
- ^ К. Померанц: «Ueber Allylcyanid und Allylsenföl», in: Justus Liebigs Annalen der Chemie, 1906, 351 (1–3), P. 354–362: doi: 10.1002 / jlac.19073510127
- ^ А. Клаус: "Ueber Crotonsäure", в: Justus Liebigs Annalen der Chemie, 1864, 131 (1), P. 58–66; doi: 10.1002 / jlac.18641310106
- ^ а б H. Tanii et al. Аллилнитрил: образование из крестоцветных овощей и поведенческие эффекты у мышей при повторном воздействии / Food and Chemical Toxicology, 42, (2004), 453-458
- ^ L.G. West et al. Производство аллил изотиоцианата и аллилцианида в бесклеточных экстрактах листьев капусты, измельченной капусте и Cole Slaw / J. Agric. Food Chem. Vol. 25, No. 6, (1997), 1234-1238
- ^ C. Krul et al. Метаболизм синигрина (2-пропенилглюкозинолата) микрофлорой толстой кишки человека в динамической модели толстого кишечника in vitro / Канцерогенез, Vol. 24, № 6, (2002), 1009-1016
- ^ L. Zhang et al. Цианид аллила как новая функциональная добавка в электролите на основе пропиленкарбоната для литий-ионных батарей Iconics, август 2013 г., том 19, выпуск 8, стр. 1099-1103
- ^ E. Balbuena, J. Llorens Поведенческие нарушения и сенсорная патология после воздействия аллилнитрила на крыс / Brain Research 904 (2001) 298-306
- ^ C. Soler-Martín et al. Бутеннитрилы имеют низкий аксонопатический потенциал в крысах / Toxicology Letters 200 (2011) 187-193.
- ^ Xiao-ping Zang et al. Поведенческие аномалии и апоптотические изменения в нейронах головного мозга мышей после однократного введения аллилнитрила / Arch Toxicol 73 (1999) 22-32
- ^ Дункан А. Дж. И Милн Дж. А. (1992), Микробное разложение аллилцианида в рубце как возможное объяснение устойчивости овец к глюкозинолатам, полученным из капусты. J. Sci. Food Agric., 58: 15–19.
- ^ А. Э. Ахмед и М. Ю. Фаруки: Сравнительная токсичность алифатических нитрилов. Toxicol. Лен. 12, 157–163 (1982)
- ^ Э. Ахмед, М. Ю. Х. Фаруки и Н. М. Тнефф: Нитрилы. В: «Биотрансформация чужеродных соединений» (М. В. Андерс, редактор), стр. 485-510. Академик Пресс, Нью-Йорк, 1985.
- ^ Х. Тани, Ю. Куросака, М. Хаяши и К. Хашимото: Аллилнитрил: соединение, которое после однократного введения вызывает длительную дискинезию у мышей. Exp. Neurol. 103, 64-67 (1989).
