WikiDer > Перренат аммония
 | |
 | |
| Имена | |
|---|---|
| Другие имена Перренат аммония, Перренат аммония (VII) | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.033.690 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| NH4ReO4 | |
| Молярная масса | 268,2359 г / моль |
| Плотность | 3,97 г / см3, твердый |
| Температура плавления | ° C |
| 2,8 г / 100 мл (0 ° C), 6,2 г / 100 мл (20 ° C), 12,0 г / 100 мл (40 ° C), 20,7 г / 100 мл (60 ° C), 32,3 г / 100 мл ( 80 ° C), 39,1 г / 100 мл (90 ° C) | |
| Структура | |
| шеелит | |
| Нет данных | |
| Опасности | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой анионы | Манганат аммония; пертехнетат аммония |
Другой катионы | Перренат натрия; перреновая кислота |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Перренат аммония (APR) - это аммоний соль перреновая кислота, NH4ReO4. Это наиболее распространенная форма, в которой рений торгуется. Это белая водорастворимая соль. Впервые он был описан вскоре после открытия рения.[1]
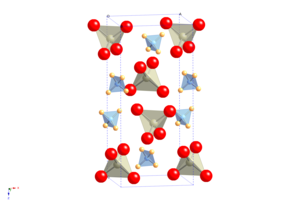
Структура
Кристаллическая структура APR - это структура шеелит, в котором атомарный катион заменен на молекулярный катион аммония.[2] Он претерпевает переход молекулярного ориентационного упорядочения при охлаждении без изменения пространственной группы, но с сильно анизотропным изменением формы ячейка, что приводит к необычному свойству иметь положительную температуру и давление Re NQR коэффициент.[3]
NH4ReO4 можно рассматривать как прототип структуры семейства шеелитов аммония, в которое входят пертехнетат (NH4TcO4), периодировать (NH4IO4), тетрахлороталлат (NH4TlCl4) и тетрахлориндат (NH4InCl4).[2]
Подготовка
Перренат аммония может быть получен практически из всех распространенных источников рения. Металл, оксиды и сульфиды могут быть окислены азотная кислота и полученный раствор обрабатывают водным аммиаком. В качестве альтернативы водный раствор Re2О7 можно обработать аммиаком с последующей кристаллизацией.[4][5]
Реакции
Чистый рений порошок может быть получен из APR путем его нагревания в присутствии водород:[4]
- 2 NH4ReO4 + 7 часов2 → 2 Re + 8 H2O + 2 NH3
Нагревание необходимо проводить медленно, поскольку перренат аммония разлагается до летучих веществ. Re2О7 начиная с 250 ° C. При нагревании в запаянной трубке до 500 ° C APR разлагается до диоксид рения:[4]
- 2NH4ReO4 → 2ReO2 + N2 + 4 часа2О
Рекомендации
- ^ Noddack, J .; Ноддак, В. (1929). "Die Sauerstoffverbindungen des Rheniums". Zeitschrift für anorganische und allgemeine Chemie. 181 (6): 1–37. Bibcode:1929NW ..... 17 ... 93N. Дои:10.1002 / zaac.19291810102.
- ^ а б И. П. Свейнсон и Р. Дж. К. Браун (1997). «Уточнение структуры перрената аммония с использованием псевдоспиновой модели для ориентации иона аммония». Acta Crystallographica. B53: 76–81. Дои:10.1107 / S0108768196011160.
- ^ Р. Дж. К. Браун и С. Л. Сегел (1977). "187Re, 14N и 2H ядерные квадрупольные связи в NH4ReO4: Доказательства возможного фазового перехода ». Журнал химической физики. 67 (7): 3163–7. Bibcode:1977ЖЧФ..67.3163Б. Дои:10.1063/1.435229.
- ^ а б c О. Глемсер «Перренат аммония» в Справочник по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, Нью-Йорк. т. 1. п. 1476–85.
- ^ Ричард Дж. Томпсон (1966). «Перренат аммония». Неорганические синтезы. 8: 171–173. Дои:10.1002 / 9780470132395.ch44. ISBN 9780470132395.
- Wm. Т. Смит, С. Хармон Лонг (1948). «Соли перреновой кислоты. I. Щелочные металлы и аммоний». Журнал Американского химического общества. 70 (1): 354–356. Дои:10.1021 / ja01181a110.