WikiDer > Антитромбиновые аптамеры - Википедия
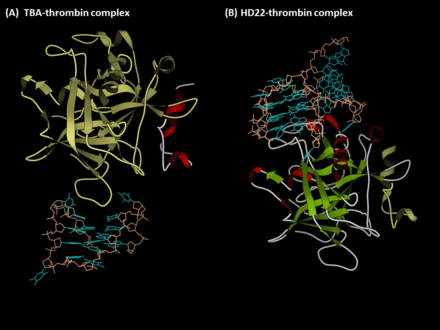
Антитромбин аптамеры находятся G-квадруплекс-несущий олигонуклеотиды, который распознает экзозиты человека тромбин. Первый антитромбиновый аптамер, TBA, был получен с помощью SELEX (Систематическая эволюция лигандов путем экспоненциального обогащения) в 1992 году L.C. Бок, Дж. Дж. Тул и коллеги.[1] Второй тромбин-связывающий аптамер, HD22, распознает экзосайт тромбина II и был открыт в 1997 г. компанией NeXstar (сейчас Gilead Sciences).[2] Эти два аптамера обладают высокой аффинностью и хорошей специфичностью, они широко изучены и используются для разработки терапевтических и диагностических средств на основе аптамеров.
Аптамер ТВА (экзосайт I-связывающий аптамер)
Аптамер TBA (также известный как G15D, HTQ, HD1 или ARC183) представляет собой 15-мерную одноцепочечную ДНК с последовательностью 5'-GGTTGGTGTGGTTGG-3 '.[1] Он взаимодействует с экзосайтом I человеческого альфа-тромбина, который является сайтом связывания фибриноген, поэтому этот аптамер действует как антикоагулянтный агент, ингибируя активацию фибриногена, а также агрегацию тромбоцитов. Кроме того, TBA показывает хорошее сродство и специфичность в отношении тромбина. Константа диссоциации TBA-тромбина измеряется в наномолярном диапазоне, и TBA не взаимодействует с другими белками плазмы или аналогами тромбина (например, гамма-тромбином).[3] В результате TBA использовался в качестве краткосрочного антикоагулянта, предназначенного для применения в хирургии шунтирования коронарной артерии, а его оптимизированная форма (NU172) в настоящее время проходит фазу II клинических испытаний ARCA Biopharma (NCT00808964). .[4] Кроме того, из-за его высокой аффинности и специфичности, для диагностики тромбоза были разработаны различные датчики, связанные с ТБА.
Структура TBA
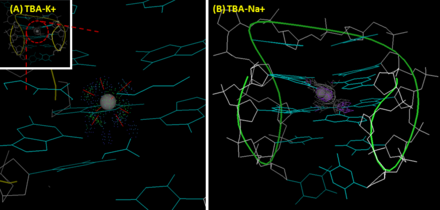
Третичная структура TBA - антипараллельный G-квадруплекс. Эта похожая на стул конструкция складывается из двух гуанин (G) -тетрадыи четыре гуанины взаимодействуют друг с другом через водородные связи, не похожие на Ватсона-Крика (скорее, водородные связи типа Хугстина). В структуре ТВА G1, G6, G10 и G15 образуют верхний слой G-тетрады; G2, G5, G11 и G14 образуют второй слой. Первые кристаллографические изображения с разрешением 2,9 Å (1HUT) было сообщено в 1993 году. Оно показало, что петля T7-G8-T9 и петля TT (T3-T4 и T12-T13) соединяют узкую и широкую канавки соответственно.[5] Однако, поскольку улучшенный ЯМР (1HAO) [6] и рентгеновские кристаллографические изображения (4DIH; 4DII) [7] были предоставлены, другая топология с петлей TGT на широкой стороне и петлями TT на узких участках была рассмотрена как правильная структура TBA.
Помимо селективности к белку, ТВА также проявляет предпочтение по ионам. А калий ion помогает TBA складываться в структуру G-квадруплекса, что приводит к значительной положительной полосе при 295 нм и отрицательной полосе при 270 нм на его поверхности. круговой дихроизм (CD) спектр. Кроме того, ион калия улучшает термическую стабильность ТВА.[8] Температура плавления G-квадруплекса ТВА (измерение изменения интенсивности пика при 295 нм с помощью CD) в присутствии натрий ион и калий равны 24 и 53 ℃ соответственно.[7] По сравнению с натрием ион калия идеально вписывается в полость между двумя плоскостями G-тетрад и координированно связан с четырьмя атомами O6 в каждой плоскости. Это увеличивает структурную стабильность ТВА. Напротив, из-за своего небольшого размера ион натрия может взаимодействовать только с четырьмя, а не с восемью атомами кислорода двух плоскостей G-тетрад и, соответственно, имеет два альтернативных положения в полости. Тромбин оказывает такое же влияние, как и ион калия. В условиях дефицита ионов тромбин помогает TBA сформироваться в стабильную структуру G-квадруплекса из рандомизированного клубка, что приводит к конформационным изменениям.[8] Некоторые группы используют это свойство для разработки сенсоров тромбина на основе аптамеров. Для этого TBA обычно монтируется с дополнительной последовательностью с FRET (Фёрстеровский резонансный перенос энергии) пара для образования переходной дуплексной структуры. Как только часть TBA взаимодействует с тромбином, конформационное изменение изменит расстояние между парой FRET и приведет к флуоресцентному выходу. Этот подход обеспечивает наномолярную чувствительность и позволяет определять тромбин в сыворотке с добавкой.[9]
mTBA
В 1996 году сообщалось о модифицированном ТВА с инверсией полярности цепи, известном как mTBA. Была разработана инверсия 5'-5 'между Т3 и Т4 в последовательности mTBA (3'-GGT-5'-5'TGGTGTGGTTGG-3 '). Это улучшает термическую стабильность структуры G-квадруплекса и увеличивает температуру плавления на 4 ℃. Несмотря на это, антикоагулянтная активность снижается за счет конструкции инверсии.[10]
Взаимодействие между ТБК и тромбином
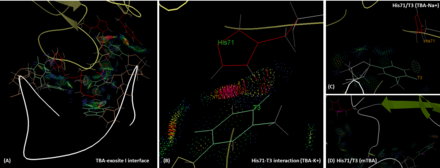
ТБА связывается с экзосайтом I тромбина в основном через две его петли ТТ (Т3, Т4 и Т12, Т13) посредством полярных и гидрофобных взаимодействий. Остатки His71, Arg75, Tyr76, Arg77, Asn78, Ile79, Tyr117 в эпитопе экзосайта I участвуют во взаимодействии с TBA.[7] Экзозит 1, будучи положительно заряженным мотивом, участвует в этих взаимодействиях с отрицательно заряженным остовом HD1.[11] Важно отметить, что Т3 взаимодействует с His71, который играет критическую роль в распознавании фибриногена,[12] как за счет водородных связей, так и за счет гидрофобного взаимодействия. Однако в присутствии иона натрия водородная связь между T3 и His71 теряется, и межмолекулярное расстояние больше, чем в случае калия. Это снижает сходство и функциональность TBA. Похожая ситуация наблюдается в случае с mTBA. Между mTBA и His71 нет взаимодействий, что приводит к снижению антикоагулянтной активности.[13] Результаты расчетов In silico с использованием метода молекулярной механики площади Пуассона-Больцмана (MM-PBSA) показывают, что рассчитанная энергия связи (ΔG) ТБК с экзосайтом I тромбина немного выше при наличии K + (-66,73 ккал.моль -1), чем в случае Na + (-60,29 ккал · моль-1), однако оба состояния, вероятно, сосуществуют.[14]
Терапевтические приложения
Было продемонстрировано, что ТВА может ингибировать тромбин-индуцированную агрегацию тромбоцитов и активность тромбина, связанного со сгустком. IC50 ТБА для ингибирования агрегации тромбоцитов (0,5 Ед / мл тромбина) составляет от 70 до 80 нмоль / л, что намного ниже, чем у гирудина (~ 1,7 мкмоль / л). Кроме того, по сравнению с гепарином, ТВА более эффективен в ингибировании связанного со сгустком тромбина.[15] Кроме того, ТВА распознает и ингибирует протромбин с аналогичным сродством к альфа-тромбину. В результате TBA продлевает протромбиновое время при взаимодействии с протромбином.[16] Компания TBA вошла в фазу I клинических испытаний хирургического шунтирования коронарной артерии Archemix и Nuvelo (теперь ARCA Biopharma) примерно в 2005 году. Несмотря на то, что он показал быстрое начало реакции с желаемой антикоагулянтной активностью, эта активность требует значительно высоких доз ТВА.[17] Таким образом, компании переработали последовательность TBA и разработали 26-мерный ДНК-аптамер второго поколения, известный как NU172, который сейчас проходит фазу II клинических испытаний.[4]
Аптамер HD22 (аптамер, связывающий экзосайт II)
Аптамер HD22 (также известный как HTDQ) представляет собой оптимизированный аптамер с 29 (5'-AGTCCGTGGTAGGGCAGGTTGGGGTGACT-3 ') или 27 (без первого и последнего нуклеотидов 29-мерной формы) нуклеотидов.[2] Этот аптамер распознает экзосайт II тромбина, который участвует в активации фактор V и фактор VIII и посредничает гепарин привязка. Следовательно, HD22 ингибирует активацию факторов V / VIII, а не фибриногена. Несмотря на то, что этот аптамер проявляет лишь умеренное влияние на регуляцию фибриногена, сродство этого аптамера немного выше, чем у TBA (KD ~ 0,5 нМ), и в настоящее время этот аптамер широко используется для разработки сенсоров аптамеров.
Структура HD22
В отличие от TBA, HD22 имеет смешанную структуру дуплекс / G-квадруплекс. Недавно было опубликовано рентгеновское кристаллографическое изображение HD22 (27-мерная форма) с разрешением 2,4 Å (4I7Y). Нуклеотиды 1-3 и 25-27 с дополнительным C4-G23 образуют дуплексный мотив, а последовательность от G5 до G20 складывается в структуру G-квадруплекса с четырьмя петлями соединения: T9-A10, T18-T19, G13- C14-A15 и однонуклеотидная петля (T6). В ядре мотива G-квадруплекса две плоскости G-тетрад образованы G5-G7-G12-G16 и G8-G11-G17-G20. Верхняя плоскость (G5-G7-G12-G16) не является типичной G-тетрадой с цепной топологией анти-син-анти-син чередование. Вместо этого три гуанина (G5, G7 и G16) принимают син конформация, и только один гуанин (G12) принимает анти конформация. Кроме того, однонуклеотидная петля вставлена между G5 и G7. Благодаря им G-тетрада образуется не по типично циклической схеме. Этот необычный план G-тетрад образован четырьмя водородными связями: одна на N2: N7 (G5-G16), две на O6: N7 (G12-G7; G16-G12) и одна на O6: N2 (G7-G5). Некоторые другие взаимодействия могут быть обнаружены в мотиве G-квадруплекса: две пары оснований Уотсона-Крика (T6-A15 и A10-T19) и G-вилка (G5-G21). Важно отметить, что из-за взаимодействия между G5 и G21 существует поворот на 90 градусов между G-qudruplex и дуплексными мотивами.[18]
Взаимодействие между HD22 и тромбином
Нуклеотиды G23, T24, G25, A26, C27 в дуплексе и T9, T18, T19, G20 в G-квадруплексе способствуют взаимодействию с экзосайтом II тромбина. Со стороны белка во взаимодействии участвуют остатки Tyr89, His91, Pro92, Arg93, Tyr94, Asn95, Trp96, Arg97, Arg126, Leu130, Arg165, Lys169, His230, Arg233, Trp237, Val241 и Phe245 в тромбине. Поскольку экзозит II является положительно заряженным мотивом, он создает множество ионных пар с основной цепью HD22, особенно в дуплексной области. Гидрофобные взаимодействия в основном наблюдаются в области G-квадруплекса (T9, T18 и T10), и это стабилизирует комплексообразование. Кроме того, взаимодействие с тромбином улучшает термическую стабильность структуры HD22 и приводит к увеличению температуры плавления (с 36 до 48 ℃).[18] Расчетная энергия связывания HD22 с экзосайтом II тромбина составляет -88,37 ккал · моль-1.[14]
Эффект авидности ТВА и HD22
Подобно антителам, аптамеры TBA и HD22 показывают жадность эффект против тромбина после димеризации. Когда TBA и HD22 конъюгированы с оптимальным линкером[19][20] или совместная печать на поверхности сенсора с оптимальной плотностью,[21] аффинность к тромбину может быть значительно увеличена в 100–10 000 раз. Кроме того, димеризация также улучшает антикоагулянтную активность. Конструкция TBA-HD22 (связанная с 16-мерным полиА) демонстрирует значительное улучшение как в анализе активированное частичное тромбопластиновое время, время свертывания и тромбин-индуцированная агрегация тромбоцитов. Конструкция TBA-HD22 показывает сравнимую эффективность по сравнению с бивалирудин, но гораздо мощнее, чем аргатробан. Кроме того, авидность TBA-HD22 можно проверить время свертывания экарина. Экарин активирует протромбин и соответственно производит мейзотромбин. Экзозит II недоступен в мейзотромбине, поэтому часть HD22 не может напрямую взаимодействовать с мейзотромбином. В результате конструкция TBA-HD22 не может улучшить время свертывания экарина, что дополнительно демонстрирует, что улучшение функциональности аптамера связано с авидностью TBA-HD22.[22]
Рекомендации
- ^ а б Бок, Л. С. и др., Выбор одноцепочечных молекул ДНК, которые связывают и ингибируют человеческий тромбин. Nature 355, 564-566, DOI: 10.1038 / 355564a0 (1992).
- ^ а б Тассет, Д. М. и др., Олигонуклеотидные ингибиторы тромбина человека, которые связывают отдельные эпитопы. Журнал молекулярной биологии 272, 688-698, DOI: 10.1006 / jmbi.1997.1275 (1997).
- ^ Ли, Дж. Дж. И др., Молекулярные аптамерные маяки для распознавания белков в реальном времени. Сообщения биохимических и биофизических исследований 292, 31-40, DOI: 10.1006 / bbrc.2002.6581 (2002).
- ^ а б http://www.clinicaltrials.gov/ct2/show/NCT00808964?term=NU+172&rank=1
- ^ Padmanabhan, K. et al., Структура альфа-тромбина ингибируется 15-мерным аптамером одноцепочечной ДНК. Журнал биологической химии 268, 17651-17654 Идентификатор PubMed: 8102368 (1993).
- ^ Падманабхан, К. и Тулински, А. Неоднозначная структура 15-мерного тромбинового комплекса ДНК. Acta Crystallographica Section D 52, 272-282, DOI: 10.1107 / S0907444995013977 (1996).
- ^ а б c Руссо Краусс, И. и др. Структуры с высоким разрешением двух комплексов между тромбином и тромбин-связывающим аптамером проливают свет на роль катионов в ингибирующей активности аптамера. Nucleic Acids Research 40, 8119-8128, DOI: 10.1093 / nar / gks512 (2012).
- ^ а б Nagatoishi, S. et al., Спектры кругового дихроизма демонстрируют образование тромбин-связывающего ДНК-аптамера G-квадруплекса в условиях дефицита стабилизирующих катионов. Сообщения о биохимических и биофизических исследованиях 352, 812-817, DOI: 10.1016 / j.bbrc.2006.11.088 (2007).
- ^ Чи, С. В. и др., Аптамерный маяк с квантовыми точками с использованием интеркалирующего красителя ДНК в качестве репортера FRET: применение для обнаружения тромбина без метки. Биосенсоры и биоэлектроника 26, 3346-3352, DOI: 10.1016 / j.bios.2011.01.015 (2011).
- ^ Мартино, Л. и др. Новый модифицированный аптамер, связывающий тромбин, содержащий 5'-5'-сайт инверсии полярности. Nucleic Acids Research 34, 6653-6662, DOI: 10.1093 / nar / gkl915 (2006)
- ^ ([Abhijit Rangnekar, Jessica A. Nash, Bethany Goodfred, Yaroslava G. Yingling, & Thomas H. Labean. (2016). Дизайн мощных и контролируемых антикоагулянтов с использованием ДНК-аптамеров и наноструктур. Molecules, 21 (2), 202]) .
- ^ Цзян М. и др. Функциональное картирование поверхностных остатков тромбина человека. Журнал биологической химии 270, 16854-16863 Идентификатор PubMed: 7622501(1995).
- ^ Руссо Краусс, И. и др. Распознавание тромбин-аптамера: выявленная двусмысленность. Nucleic Acids Research 39, 7858-7867, DOI: 10.1093 / nar / gkr522 (2011).
- ^ а б Трапаидзе, А. и др. Способы связывания тромбин-связывающих аптамеров исследованы с помощью моделирования и экспериментов. Письма по прикладной физике, 106, 043702, [1] (2015).
- ^ Li, W. X. et al., Новый ингибитор тромбина на основе нуклеотидов подавляет тромбин, связанный с тромбом, и снижает образование тромбов в артериальных тромбоцитах. Кровь 83, 677-682 Идентификатор PubMed: 8298130 (1994).
- ^ Kretz, C.A. et al., HD1, тромбин-направленный аптамер, связывает экзосайт 1 на протромбине с высоким сродством и ингибирует его активацию протромбиназой. Журнал биологической химии 281, 37477-37485, DOI: 10.1074 / jbc.M607359200 (2006).
- ^ Schwienhorst, A. Прямые ингибиторы тромбина - обзор последних разработок. Cellular and Molecular Life Sciences 63, 2773-2791, DOI: 10.1007 / s00018-006-6219-z (2006).
- ^ а б Russo Krauss, I. et al., Дуплекс-квадруплекс мотивы в своеобразной структурной организации кооперативно вносят вклад в связывание тромбина аптамера ДНК. Acta Crystallographica Section D 69, 2403-2411, DOI: 10.1107 / S0907444913022269 (2013).
- ^ Трапаидзе, А .; и другие. (2015). «Обнаружение тромбина в плазме мышей с использованием аптадимеров с искусственным флуоресцентным резонансным переносом энергии». Письма по прикладной физике. 107 (23): 233701. Дои:10.1063/1.4937351. ISSN 0003-6951.
- ^ Hasegawa, H. et al., Повышение сродства аптамера путем димеризации. Датчики 8, 1090-1098 DOI: 10.3390 / s8021090(2008).
- ^ Лао, Ю. Х. и др., Повышение чувствительности аптамерного микрочипа за счет оптимизации спейсера и эффекта авидности. Аналитическая химия 81, 1747-1754, DOI: 10.1021 / ac801285a (2009).
- ^ Muller, J. et al., Антикоагулянтные характеристики HD1-22, двухвалентного аптамера, который специфически ингибирует тромбин и протромбиназу. Журнал тромбоза и гемостаза 6, 2105-2112, DOI: 10.1111 / j.1538-7836.2008.03162.x (2008).