WikiDer > Автокатализ
Эта статья нужны дополнительные цитаты для проверка. (Сентябрь 2010 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Один химическая реакция как говорят автокаталитический если один из продуктов реакции также является катализатор для такой же или парной реакции.[1] Такая реакция называется автокаталитическая реакция.
А набор химических реакций можно назвать «коллективно автокаталитическими», если некоторые из этих реакций производят в качестве продуктов реакции катализаторы для достаточного количества других реакций, так что весь набор химических реакций является самоподдерживающимся с учетом поступления энергии и молекул пищи (видеть автокаталитический набор).
Химические реакции
Химическая реакция двух реагентов и двух продуктов может быть записана как
где греческие буквы стехиометрические коэффициенты а заглавные латинские буквы обозначают химические вещества. Химическая реакция протекает как в прямом, так и в обратном направлении. Это уравнение легко обобщается на любое количество реагентов, продуктов и реакций.
Химическое равновесие
В химическое равновесие вперед и назад скорость реакции таковы, что каждый химический вид создается с той же скоростью, что и уничтожается. Другими словами, скорость прямой реакции равна скорости обратной реакции.
Здесь скобки указывают на концентрацию химического вещества в родинки на литр, а k+ и k− находятся константы скорости.
Вдали от равновесия
Вдали от равновесия скорости прямой и обратной реакции больше не уравновешиваются, и концентрация реагентов и продуктов больше не является постоянной. Для любой прямой реакции молекулы A разрушаются. За каждую обратную реакцию создаются молекулы A. В случае элементарная реакция шагнуть порядок реакции в каждом направлении равна молекулярности, так что скорость изменения количества молей A тогда
Эта система уравнений имеет одну устойчивую фиксированная точка когда форвардный курс и обратный курс равны (когда для каждого вида). Это означает, что система переходит в состояние равновесия, и это единственное состояние, в которое она переходит.[2]
Автокаталитические реакции
Автокаталитические реакции - это реакции, в которых по крайней мере один из продуктов является реагентом. Пожалуй, простейшую автокаталитическую реакцию можно записать[1]
со скоростными уравнениями (для элементарной реакции)
- .
Эта реакция представляет собой реакцию, в которой молекула вида A взаимодействует с молекулой вида B. Молекула A превращается в молекулу B. Конечный продукт состоит из исходной молекулы B плюс молекулы B, созданной в результате реакции.
Ключевой особенностью этих соотношений ставок является то, что они нелинейный; второй член справа изменяется как квадрат концентрации B. Эта особенность может привести к множеству фиксированных точек системы, как и квадратное уровненеие может иметь несколько корней. Множественные фиксированные точки допускают множественные состояния системы. Система, существующая в нескольких макроскопический состояний более упорядочен (имеет более низкую энтропию), чем система в одном состоянии.
Концентрации A и B меняются во времени в зависимости от[1][3]
и
- .
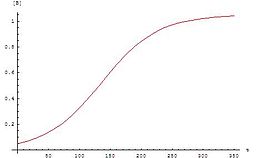
График для этих уравнений представляет собой сигмовидная кривая (в частности логистическая функция), что характерно для автокаталитических реакций: эти химические реакции вначале протекают медленно ( индукционный период), поскольку катализатора мало, скорость реакции постепенно увеличивается по мере протекания реакции по мере увеличения количества катализатора, а затем снова замедляется по мере уменьшения концентрации реагента. Если концентрация реагента или продукта в эксперименте следует сигмовидной кривой, реакция может быть автокаталитической.
Эти кинетические уравнения применимы, например, к катализируемому кислотой гидролизу некоторых сложные эфиры к карбоновые кислоты и спирты.[3] Для запуска каталитического механизма сначала должно присутствовать хотя бы некоторое количество кислоты; в противном случае реакция должна начинаться альтернативным некатализируемым путем, который обычно протекает медленнее. Приведенные выше уравнения для каталитического механизма означают, что концентрация кислотного продукта всегда остается нулевой.[3]
Создание заказа
Фон
В второй закон термодинамики заявляет, что беспорядок (энтропия) физической или химической системы и ее окружения (a закрытая система) со временем должен увеличиваться. Системы, предоставленные сами себе, становятся все более случайный, и упорядоченная энергия системы, подобная равномерному движению, в конечном итоге деградирует до случайного движения частиц в тепловая ванна.
Однако во многих случаях физические системы спонтанно становятся возникающий или аккуратно. Например, несмотря на разрушения, которые они вызывают, ураганы иметь очень упорядоченный вихрь движение по сравнению со случайным движением молекул воздуха в закрытом помещении. Еще более впечатляющим является порядок, созданный химическими системами; наиболее драматичным является порядок, связанный с жизнью.
Это согласуется со Вторым законом, который требует, чтобы полный беспорядок системы и его окрестности со временем должен увеличиваться. Порядок может быть создан в системе еще большим уменьшением порядка в окружении системы.[4] В примере с ураганом ураганы образуются из-за неравномерного нагрева атмосферы. Атмосфера Земли тогда далека от тепловое равновесие. Порядок земной атмосферы увеличивается, но за счет порядка Солнца. С возрастом Солнце становится все более беспорядочным и отбрасывает свет и материалы на остальную вселенную. Общий беспорядок на Солнце и на Земле увеличивается, несмотря на то, что на Земле возникают упорядоченные ураганы.
Аналогичный пример существует для живых химических систем. Солнце дает энергию зеленым растениям. Зеленые растения - пища для других живых химических систем. Энергия, поглощаемая растениями и преобразуемая в химическую энергию, создает на Земле систему, которая упорядочена и далека от химическое равновесие. Здесь отличие от химического равновесия определяется избытком реагентов над равновесным количеством. И снова порядок на Земле создается за счет увеличения энтропии Солнца. Общая энтропия Земли и остальной Вселенной увеличивается в соответствии со Вторым законом.
Некоторые автокаталитические реакции также создают порядок в системе за счет ее окружения. Например, (часы реакции) имеют промежуточные звенья концентрации которых колеблются во времени, что соответствует временному порядку. Другие реакции вызывают пространственное разделение химические вещества соответствующий пространственному порядку. Более сложные реакции участвуют в метаболические пути и метаболические сети в биологические системы.
Переход к порядку с увеличением расстояния от равновесия обычно не является непрерывным. Порядок обычно появляется внезапно. Порог между нарушением химического равновесия и порядком известен как фаза перехода. Условия фазового перехода могут быть определены с помощью математического аппарата неравновесная термодинамика.
Временной порядок
Химическая реакция не может колебаться вокруг позиции конечной равновесие потому что второй закон термодинамики требует, чтобы термодинамическая система приблизиться к равновесию и не отступать от него. Для закрытой системы при постоянной температуре и давлении Свободная энергия Гиббса должен непрерывно уменьшаться и не колебаться. Однако возможно, что концентрации некоторых промежуточные продукты реакции колеблются, а также что ставка образования продуктов колеблется.[5]
Идеализированный пример: уравнение Лотки – Вольтерра.

Рассмотрим совокупность двух автокаталитических реакций, в которых концентрация одного из реагентов A намного превышает его равновесное значение. В этом случае скорость прямой реакции настолько больше, чем скорость обратной, что мы можем пренебречь скоростью обратной.
со скоростными уравнениями
- .
Здесь мы пренебрегли истощением реагента A, поскольку его концентрация очень велика. Константы скорости для трех реакций: , , и , соответственно.
Эта система скоростных уравнений известна как Уравнение Лотки – Вольтерра и наиболее тесно связан с динамика населения в отношениях хищник – жертва. Эта система уравнений может давать колеблющиеся концентрации промежуточных продуктов реакции X и Y. Амплитуда колебаний зависит от концентрации A (которая уменьшается без колебаний). Такие колебания представляют собой форму возникающего временного порядка, которого нет в равновесии.
Другой идеализированный пример: Брюсселатор.
Другим примером системы, демонстрирующей временной порядок, является Брюсселятор (см. ссылку на Пригожина). Для него характерны реакции
со скоростными уравнениями
где для удобства константы скорости были установлены на 1.

Брюсселятор имеет фиксированную точку на
- .
Фиксированная точка становится нестабильной, когда
приводящие к колебаниям системы. В отличие от уравнения Лотки-Вольтерра, колебания брюсселятора не зависят от количества реагента, присутствующего изначально. Вместо этого по прошествии достаточного времени колебания приближаются к предельный цикл.[6]
Пространственный порядок
Идеализированный пример пространственного спонтанное нарушение симметрии это случай, когда у нас есть две коробки с материалом, разделенные проницаемой мембраной, так что материал может размытый между двумя коробками. Предполагается, что в каждой коробке находятся идентичные брюсселяторы с почти одинаковыми начальными условиями. (см. ссылку на Пригожина)
Здесь числовые нижние индексы указывают, в каком ящике находится материал. Есть дополнительные члены, пропорциональные коэффициенту диффузии D, которые учитывают обмен материала между ящиками.
Если система запускается с одинаковыми условиями в каждом ящике, то небольшое отклонение приведет к разделению материалов между двумя ящиками. В одном поле будет преобладать X, а в другом - Y.
Реальные примеры
Реальные примеры часы реакции являются Реакция Белоусова – Жаботинского (Реакция БЖ), Реакция Бриггса – Раушера, то Реакция Брея – Либхафски и йод часы реакция. Это колебательные реакции, и концентрацию продуктов и реагентов можно приблизительно оценить в терминах затухающий колебания.
Самая известная реакция, реакция BZ, может быть создана с помощью смеси бромата калия. , малоновая кислота , и сульфат марганца приготовлено в нагретом растворе с серной кислотой как растворитель.[7]
Пример оптики
Другая автокаталитическая система - это система, управляемая светом, взаимодействующим с реакциями фотополимеризации. В процессе, называемом оптическим автокатализом, создается положительная обратная связь между интенсивностью света и скоростью фотополимеризации посредством увеличения показателя преломления, вызванного полимеризацией. Предпочтение света занимать области с более высоким показателем преломления приводит к утечке света в области с более высоким молекулярным весом, тем самым усиливая фотохимическую реакцию. Положительный отзыв может быть выражен как:[8]
Отмечая, что скорость фотополимеризации пропорциональна интенсивности[9] и этот показатель преломления пропорционален молекулярной массе,[10] положительная обратная связь между интенсивностью и фотополимеризацией устанавливает автокаталитическое поведение. Было показано, что оптический автокатализ приводит к спонтанному формирование рисунка в фотополимерах.[11][12][13] Хосейн и его сотрудники обнаружили, что оптический автокатализ также может происходить в смесях фотореактивных полимеров и что этот процесс может вызывать морфологии бинарных фаз с той же структурой, что и световой профиль.[8] Свет подвергается оптическому модуляционная нестабильность, самопроизвольное разделение на множество оптических волокон, и полимерная система, таким образом, образует волокна внутри смешанной структуры.[8] В результате появилась новая система, сочетающая оптические автокаталитические свойства с спинодальный распад.
Биологический пример
Известно, что важный метаболический цикл, гликолиз, отображает временной порядок.[14] Гликолиз состоит из разложения одной молекулы глюкозы и общего образования двух молекул АТФ. Таким образом, этот процесс имеет большое значение для энергетики живых клеток. Глобальная реакция гликолиза включает глюкоза, ADP, НАД, пируват, АТФ, и НАДН.
- .
Детали процесса довольно сложны, однако часть процесса автокатализируется фосфофруктокиназа (ПФК). Эта часть процесса отвечает за колебания пути, которые приводят к колебаниям процесса между активной и неактивной формой. Таким образом, автокаталитическая реакция может модулировать процесс.
Пошив формы тонких слоев
Можно использовать результаты автокаталитической реакции в сочетании с система реакция – диффузия теория, чтобы адаптировать дизайн тонкого слоя. Автокаталитический процесс позволяет контролировать нелинейное поведение окисления. передний, который используется для определения начальной геометрии, необходимой для создания произвольной окончательной геометрии.[15] Это было успешно выполнено при влажном окислении для получения слоев произвольной формы .
Фазовые переходы
Начальные количества реагентов определяют расстояние от химического равновесия системы. Чем выше начальные концентрации, тем дальше система от равновесия. С увеличением начальной концентрации резкое изменение порядок происходит. Это резкое изменение известно как фаза перехода. При фазовом переходе флуктуации макроскопических величин, таких как химические концентрации, увеличиваются, поскольку система колеблется между более упорядоченным состоянием (более низкая энтропия, например, лед) и более неупорядоченным состоянием (более высокая энтропия, например, жидкая вода). Кроме того, при фазовом переходе макроскопические уравнения, такие как уравнения скорости, не работают. Уравнения скорости могут быть выведены из микроскопических соображений. Выводы обычно основываются на теория среднего поля приближение к микроскопическим динамическим уравнениям. Теория среднего поля не работает при наличии больших флуктуаций (см. Теория среднего поля статья для обсуждения). Следовательно, поскольку в окрестности фазового перехода возникают большие флуктуации, макроскопические уравнения, такие как уравнения скорости, не работают. При дальнейшем увеличении начальной концентрации система переходит в упорядоченное состояние, в котором флуктуации снова малы. (см. ссылку на Пригожина)
Асимметричный автокатализ
Асимметричный автокатализ происходит, когда продукт реакции хиральный и, таким образом, действует как хиральный катализатор для собственного производства. Реакции этого типа, такие как Соаи реакция, обладают тем свойством, что они могут усиливать очень малое энантиомерный избыток в большой. Это было предложено как важный шаг в возникновении биологических гомохиральность.[16]
Роль в зарождении жизни
В 1995 г. Стюарт Кауфман предположил, что жизнь изначально возникла как автокаталитические химические сети.[17]
Британский этолог Ричард Докинз писал об автокатализе как о возможном объяснении абиогенез в своей книге 2004 года Рассказ предков. Он цитирует эксперименты, проведенные Юлиус Ребек и его коллеги по Научно-исследовательский институт Скриппса в Калифорния в котором они объединили аминоаденозин и пентафторфениловый эфир с автокатализатором сложным эфиром аминоаденозиновой кислоты (ААТЭ). Одна система из эксперимента содержала варианты ААТЭ, которые сами катализировали синтез. Этот эксперимент продемонстрировал возможность того, что автокатализаторы могут конкурировать в популяции сущностей с наследственностью, что можно интерпретировать как рудиментарную форму естественный отбори что определенные изменения окружающей среды (например, облучение) могут изменить химическую структуру некоторых из этих самовоспроизводящихся молекул (аналог мутации) таким образом, что это может либо усилить, либо повлиять на его способность реагировать, тем самым усиливая или препятствуя его способность воспроизводиться и распространяться среди населения.[18]
Автокатализ играет важную роль в жизненных процессах. Два исследователя, подчеркнувшие его роль в возникновении жизни, - Роберт Уланович. [19] и Стюарт Кауфман.[20]
Автокатализ происходит в исходных транскриптах рРНК. Интроны способны вырезать себя в процессе двух реакций нуклеофильной переэтерификации. РНК, способная делать это, иногда называют рибозим. Кроме того, цикл лимонной кислоты автокаталитический цикл выполняется в обратном направлении.
В конечном счете, сам биологический метаболизм можно рассматривать как обширный автокаталитический набор, в котором все молекулярные составляющие биологической клетки образуются в результате реакций с участием этого же набора молекул.
Примеры автокаталитических реакций
- Фотографическая обработка из пленки галогенида серебра / бумаги
- Репликация ДНК
- Галоформная реакция
- Формозная реакция (также известная как реакция Бутлерова)
- Оловянный вредитель
- Реакция перманганата с щавелевой кислотой[21]
- Синдром уксуса
- Связывание кислорода гемоглобин
- Спонтанная деградация аспирин в салициловую кислоту и уксусную кислоту, из-за чего очень старый аспирин в закрытых контейнерах пахнет уксусом.
- Α-бромирование ацетофенон с бром.
- Кольца Лизеганга
- Автокаталитический рост поверхности металлических наночастиц в фазе раствора[22]
Смотрите также
Рекомендации
- ^ а б c Стейнфельд Дж. И., Франсиско Дж. С. и Hase W.L. Химическая кинетика и динамика (2-е изд., Прентис-Холл 1999) с.151-2 ISBN 0-13-737123-3
- ^ Росс, Джон; Гарсия-Колин, Леопольдо С. (март 1989 г.). «Термодинамика химических систем вдали от равновесия». Журнал физической химии. 93 (5): 2091–2092. Дои:10.1021 / j100342a075.
- ^ а б c Мур Дж. В. и Пирсон Р.Г. Кинетика и механизм (Джон Вили, 1981) стр.26. ISBN 0-471-03558-0
- ^ Илья Пригожин (1980). От бытия к становлению: время и сложность физических наук. Сан-Франциско: В. Х. Фриман. ISBN 978-0-7167-1107-0.
- ^ Эспенсон, Дж. Химическая кинетика и механизмы реакций (2-е изд., McGraw-Hill 2002) с.190. ISBN 0-07-288362-6
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2008-12-17. Получено 2015-10-15.CS1 maint: заархивированная копия как заголовок (связь) Динамика брюсселятора
- ^ Петерсон, Габриэль. "Реакция Белоусова-Жаботинского". Архивировано из оригинал 31 декабря 2012 г.
- ^ а б c Бирия, Саид; Malley, Phillip P.A .; Kahan, Tara F .; Хосейн, Ян Д. (15.11.2016). «Оптический автокатализ устанавливает новую пространственную динамику в фазовом разделении полимерных смесей во время фотоотверждения». Буквы макросов ACS. 5 (11): 1237–1241. Дои:10.1021 / acsmacrolett.6b00659.
- ^ Декер, Кристиан (1998-02-01). «Использование УФ-излучения в полимеризации». Полимер Интернэшнл. 45 (2): 133–141. Дои:10.1002 / (SICI) 1097-0126 (199802) 45: 2 <133 :: AID-PI969> 3.0.CO; 2-F.
- ^ Аскадский, А.А. (1990). «Влияние плотности сшивки на свойства полимерных сеток». Наука о полимерах СССР. 32 (10): 2061–2069. Дои:10.1016/0032-3950(90)90361-9.
- ^ Берджесс, Ян Б.; Шиммелл, Уитни Э .; Сараванамутту, Калайчелви (1 апреля 2007 г.). «Спонтанное образование рисунка из-за модуляционной нестабильности некогерентного белого света в фотополимеризуемой среде». Журнал Американского химического общества. 129 (15): 4738–4746. Дои:10.1021 / ja068967b. ISSN 0002-7863. PMID 17378567.
- ^ Баскер, Динеш К .; Брук, Майкл А .; Сараванамутту, Калайчелви (2015).«Самопроизвольное возникновение нелинейных световых волн и самозаписывающейся волноводной микроструктуры при катионной полимеризации эпоксидов». Журнал физической химии C. 119 (35): 20606–20617. Дои:10.1021 / acs.jpcc.5b07117.
- ^ Бирия, Саид; Malley, Philip P.A .; Kahan, Tara F .; Хосейн, Ян Д. (2016-03-03). «Настраиваемая нелинейная оптическая структура и микроструктура в сшивающих акрилатных системах во время свободнорадикальной полимеризации». Журнал физической химии C. 120 (8): 4517–4528. Дои:10.1021 / acs.jpcc.5b11377. ISSN 1932-7447.
- ^ Г. Николис и Илья Пригожин (1977). Самоорганизация в неравновесных системах.. Нью-Йорк: Джон Уайли и сыновья. ISBN 978-0-471-02401-9.
- ^ Alfaro-Bittner, K .; Rojas, R.G .; Lafleur, G .; Calvez, S .; Almuneau, G .; Clerc, M.G .; Барбей, С. (22 апреля 2019 г.). "Моделирование бокового влажного окисления в произвольной геометрии мезы". Применена физическая проверка. 11 (4): 044067. Дои:10.1103 / PhysRevApplied.11.044067.
- ^ Соай К., Сато И., Шибата Т. (2001). «Асимметричный автокатализ и происхождение хиральной гомогенности в органических соединениях». Химический рекорд. 1 (4): 321–32. Дои:10.1002 / tcr.1017. PMID 11893072.
- ^ Стюарт Кауфман (1995). Дома во Вселенной: поиск законов самоорганизации и сложности. Издательство Оксфордского университета. ISBN 978-0-19-509599-9.
- ^ Ребек, Джулиус (июль 1994). «Синтетические самовоспроизводящиеся молекулы». Scientific American: 48–55.
- ^ Экология, восходящая перспектива ", Роберт Уланович, Columbia Univ. Press 1997.
- ^ Исследования, Стюарт Кауфман.
- ^ Ковач К.А., Гроф П., Бурай Л., Ридель М. (2004). «Пересмотр механизма реакции перманганат / оксалат». J. Phys. Chem. А. 108 (50): 11026–11031. Bibcode:2004JPCA..10811026K. Дои:10.1021 / jp047061u.
- ^ Инь, Си; Ши, Мяо; Ву, Цзяньбо; Пан, Юнг-Тин; Gray, Danielle L .; Бертке, Джеффри А .; Ян, Хун (11 сентября 2017 г.). «Количественный анализ различных режимов образования нанокристаллов платины, контролируемых химией лигандов». Нано буквы. 17 (10): 6146–6150. Bibcode:2017NanoL..17.6146Y. Дои:10.1021 / acs.nanolett.7b02751. PMID 28873317.
внешняя ссылка
- Некоторые замечания по автокатализу и автопоэзису (Барри Макмаллин)
- Джайн, Санджай; Кришна, Сандип (21 декабря 1998 г.). «Автокаталитические наборы и рост сложности в эволюционной модели». Письма с физическими проверками. 81 (25): 5684–5687. arXiv:adap-org / 9809003. Bibcode:1998PhRvL..81.5684J. Дои:10.1103 / PhysRevLett.81.5684.

![k _ {+} [A] ^ { alpha} [B] ^ { beta} = k _ {-} [S] ^ { sigma} [T] ^ { tau} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/e39ee9ee8897756407253f0af9c7942c4ae75f7c)

![{d over dt} [A] = - alpha k _ {+} [A] ^ { alpha} [B] ^ { beta} + alpha k _ {-} [S] ^ { sigma} [T ] ^ { tau} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bc3ff03bd9ea137fb863f9f1b2ff77c7744d326)
![{d over dt} [B] = - beta k _ {+} [A] ^ { alpha} [B] ^ { beta} + beta k _ {-} [S] ^ { sigma} [T ] ^ { tau} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/9966e3494fe6c1963b3fcc6c0f63876edc06bed1)
![{d over dt} [S] = sigma k _ {+} [A] ^ { alpha} [B] ^ { beta} - sigma k _ {-} [S] ^ { sigma} [T] ^ { tau} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdfde6f66b67e29215874f19eb6ea81b1077f3cf)
![{d over dt} [T] = tau k _ {+} [A] ^ { alpha} [B] ^ { beta} - tau k _ {-} [S] ^ { sigma} [T] ^ { tau} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/92033c0969f2facba06dcc8b1e51e1e9bfc13dc1)


![{d over dt} [A] = - k _ {+} [A] [B] + k _ {-} [B] ^ {2} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b56d2d10120edc5f81b31eb215a3c59121d2d89e)
![{d over dt} [B] = + k _ {+} [A] [B] -k _ {-} [B] ^ {2} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fe187f10f7df89b123d47bf155e81de07b7ec74)
![[A] = { frac {[A] _ {0} + [B] _ {0}} {1 + { frac {[B] _ {0}} {[A] _ {0}}} e ^ {([A] _ {0} + [B] _ {0}) kt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/441bd0aee36b9fc56db162b05fd2e398be4c1d4d)
![[B] = { frac {[A] _ {0} + [B] _ {0}} {1 + { frac {[A] _ {0}} {[B] _ {0}}} e ^ {- ([A] _ {0} + [B] _ {0}) kt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b5b30238c201994af2b92d366d4c3776b769a4f)



![{d over dt} [X] = k_ {1} [A] [X] -k_ {2} [X] [Y] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a77b3408455b678ccec148f2a29616a697a396e)
![{d over dt} [Y] = k_ {2} [X] [Y] -k_ {3} [Y] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c44500fc1af6f74c1efab6ab4ff34389aef68e8)







![{d over dt} [X] = [A] + [X] ^ {2} [Y] - [B] [X] - [X] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/a06ea7cbff840ad50908e05f352d2e88bed2fb34)
![{d over dt} [Y] = [B] [X] - [X] ^ {2} [Y] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/148716087eb40a4d24d17bbba7c18ab3da5197fb)
![[X] = A ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c60d3f07657ef89c703f2cf343ff3f6e5dbb8cb)
![[Y] = {B over A} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae4133213f54b64dded53106d2ffd1e05ebc1ad4)

![{d over dt} [X_ {1}] = [A] + [X_ {1}] ^ {2} [Y_ {1}] - [B] [X_ {1}] - [X_ {1}] + D_ {x} left (X_ {2} -X_ {1} right) ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/43aa7b6085abaefd859fdb893bc85591dc95580a)
![{d over dt} [Y_ {1}] = [B] [X_ {1}] - [X_ {1}] ^ {2} [Y_ {1}] + D_ {y} left (Y_ {2 } -Y_ {1} right) ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/307f4adeb149593fb8aa014e4402c91a620a0dcb)
![{d over dt} [X_ {2}] = [A] + [X_ {2}] ^ {2} [Y_ {2}] - [B] [X_ {2}] - [X_ {2}] + D_ {x} left (X_ {1} -X_ {2} right) ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/58781820d50098a583038d648e2ece437cec7def)
![{d over dt} [Y_ {2}] = [B] [X_ {2}] - [X_ {2}] ^ {2} [Y_ {2}] + D_ {y} left (Y_ {1 } -Y_ {2} right) ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6aa1ef766e264e2672c3577eff536bdbbfaf4b8)







