WikiDer > Селективность привязки - Википедия
Селективность связывания определяется относительно привязки лиганды к подложке, образующей сложный. Селективность связывания описывает, как лиганд может более предпочтительно связываться с одним рецептором, чем с другим. Коэффициент селективности - это константа равновесия для реакции вытеснения одним лигандом другого лиганда в комплексе с субстратом. Селективность связывания имеет большое значение в биохимия[1] И в процессы химического разделения.
Коэффициент селективности
Концепция селективности используется для количественной оценки степени, в которой одно химическое вещество, A, связывает каждое из двух других химических веществ, B и C. В простейшем случае образованные комплексы имеют соотношение 1: 1. стехиометрия. Тогда два взаимодействия можно охарактеризовать как константы равновесия KAB и KAC.[примечание 1]
[..] представляет концентрация. А коэффициент селективности определяется как отношение двух констант равновесия.
Этот коэффициент селективности фактически является константой равновесия для реакции вытеснения.
Легко показать, что то же определение применимо к комплексам другой стехиометрии, AпBq и АпCq. Чем больше коэффициент селективности, тем больше лиганд C будет вытеснять лиганд B из комплекса, образованного с субстратом A. Альтернативная интерпретация заключается в том, что чем больше коэффициент селективности, тем ниже концентрация C, необходимая для вытеснения B из AB. . Коэффициенты селективности определяются экспериментально путем измерения двух констант равновесия: KAB и KAC.
Приложения
Биохимия
В биохимии субстрат известен как рецептор. Рецептор - это белок молекула, встроенная либо в плазматическая мембрана или цитоплазма клетки, с которой могут связываться один или несколько конкретных видов сигнальных молекул. А лиганд может быть пептид или другая небольшая молекула, такая как нейротрансмиттер, а гормон, фармацевтический препарат или токсин. Специфика рецептора определяется его пространственной геометрией и тем, как он связывает к лиганду через нековалентные взаимодействия, Такие как водородная связь или же Силы Ван-дер-Ваальса.[2]
Если рецептор можно выделить, можно разработать синтетическое лекарство для стимуляции рецептора, агонист или заблокировать его, антагонист. В язвенная болезнь желудка препарат, средство, медикамент циметидин был разработан как ЧАС2 антагонист путем химической инженерии молекулы для максимальной специфичности к изолированной ткани, содержащей рецептор. Дальнейшее использование количественные отношения структура-деятельность (QSAR) привел к разработке других агентов, таких как ранитидин.
Важно отметить, что «избирательность» в отношении лекарственного средства является относительной, а не абсолютной. Например, в более высокой дозе конкретная молекула лекарства может также связываться с другими рецепторами, чем те, которые считаются «селективными».
Хелаторная терапия
Хелатотерапия - это форма лечения, при которой хелатирующий лиганд[заметка 2] используется для выборочного удаления металла с кузова. Когда металл существует в виде двухвалентного иона, например, с вести, Pb2+ или же Меркурий, Hg2+ избирательность против кальций, Ca2+ и магний, Mg2+, важно для того, чтобы обработка не удаляла важные металлы.[3]
Избирательность определяется различными факторами. В случае железная перегрузка, что может произойти у людей с β-талесемия кто получил переливание крови, целевой ион металла находится в +3 степень окисления и поэтому образует более сильные комплексы, чем двухвалентные ионы. Он также образует более прочные комплексы с лигандами-донорами кислорода, чем с лигандами-донорами азота. дефероксамин, встречающийся в природе сидерофор продуцируется актинобактером Streptomyces pilosus и первоначально использовался как агент хелатной терапии. Синтетические сидерофоры, такие как деферипрон и деферазирокс были разработаны с использованием известной структуры дефероксамина в качестве отправной точки.[4][5] Хелатирование происходит с двумя атомами кислорода.
Болезнь Вильсона вызвано дефектом в медь метаболизм, который приводит к накоплению металлической меди в различных органах тела. Ион-мишень в этом случае двухвалентный Cu2+. Этот ион классифицируется как пограничный в схеме Арланда, Чатта и Дэвиса.[6] Это означает, что он образует примерно такие же прочные комплексы с лигандами, донорными атомами которых являются N, O или F, и с лигандами, донорными атомами которых являются P, S или Cl. Пеницилламин, который содержит донорные атомы азота и серы, используется, поскольку этот тип лиганда сильнее связывается с ионами меди, чем с ионами кальция и магния.
Лечение отравлений тяжелыми металлами, такими как свинец и ртуть, является более проблематичным, поскольку используемые лиганды не обладают высокой специфичностью по отношению к кальцию. Например, EDTA может вводиться в виде соли кальция для уменьшения удаления кальция из кости вместе с тяжелым металлом. Были рассмотрены факторы, определяющие селективность свинца против цинка, кадмия и кальция.[7]
Хроматография
В колоночной хроматографии смесь веществ растворяют в подвижной фазе и пропускают через неподвижную фазу в колонке. Коэффициент селективности определяется как отношение коэффициенты распределения, которые описывают равновесное распределение аналит между стационарной фазой и мобильной фазой. Коэффициент селективности равен коэффициенту селективности с добавленным предположением, что Мероприятия неподвижной фазы, в данном случае подложки, равно 1, что является стандартным допущением для чистой фазы.[8] Разрешение хроматографической колонки, рS связано с фактором селективности:
где α - коэффициент селективности, N это количество теоретические тарелки kА и kB являются факторы удержания двух аналитов. Коэффициенты удержания пропорциональны коэффициентам распределения. На практике можно разделить вещества с коэффициентом селективности, очень близким к 1. Это особенно верно в газожидкостная хроматография где возможна длина колонн до 60 м, что обеспечивает очень большое количество теоретических тарелок.
В ионообменной хроматографии коэффициент селективности определяется несколько иначе.[9]
Экстракция растворителем
Экстракция растворителем[10] используется для извлечения отдельных лантаноид элементы из смесей, встречающихся в природе в рудах, таких как монацит. В одном процессе ионы металлов в водном растворе заставляют образовывать комплексы с трибутилфосфат (ТБФ), которые экстрагируются органическим растворителем, таким как керосин. Полное разделение осуществляется с помощью встречный обмен метод. Ряд ячеек расположены в виде каскад. После уравновешивания водный компонент каждой ячейки переносится в предыдущую ячейку, а органический компонент переносится в следующую ячейку, которая изначально содержит только воду. Таким образом, ион металла с наиболее стабильным комплексом проходит вниз по каскаду в органической фазе, а металл с наименее стабильным комплексом проходит вверх по каскаду в водной фазе.[11]
Если растворимость в органической фазе не является проблемой, коэффициент селективности равен отношению константы устойчивости комплексов ТБФ двух ионов металлов. Для лантаноидных элементов, смежных в периодическая таблица это соотношение ненамного больше 1, поэтому в каскаде требуется много ячеек.
Химические сенсоры
Потенциометрический коэффициент селективности определяет способность ионоселективный электрод чтобы отличить один конкретный ион от других. Коэффициент селективности, КДО Н.Э оценивается посредством отклика ЭДС ионоселективного электрода в смешанных растворах первичного иона B и мешающего иона C (метод фиксированной интерференции) или, что менее желательно, в отдельных растворах B и C (метод разделения растворов).[12] Например, калий ионоселективный мембранный электрод использует природные макроциклические антибиотик валиномицин. В этом случае полость в макроциклическом кольце имеет как раз подходящий размер для инкапсуляции иона калия, но слишком велика, чтобы сильно связывать ион натрия, что, скорее всего, является помехой.
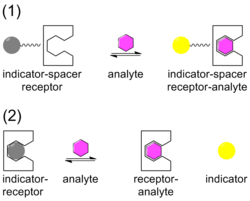
Химические сенсоры,[13][14] разрабатываются для конкретных целевых молекул и ионов, в которых мишень (гость) образует комплекс с сенсором (хозяином). Датчик разработан таким образом, чтобы идеально подходить по размеру и форме мишени, чтобы обеспечить максимальную избирательность связывания. Индикатор связан с датчиком, который претерпевает изменение, когда цель образует комплекс с датчиком. Изменение индикатора обычно представляет собой изменение цвета (с серого на желтый на иллюстрации), видимое на поглощение или, с большей чувствительностью, свечение. Индикатор может быть прикреплен к датчику через прокладку в устройстве ISR или может быть смещен с датчика в устройстве IDA.
Смотрите также
Примечания
- ^ Используемые здесь константы ассоциация константы. Диссоциация константы используются в некоторых контекстах. Константа диссоциации обратна константе ассоциации.
- ^ Термин «лиганд» здесь относится к связыванию с металлом. В определении коэффициента селективности этот «лиганд» фактически является субстратом, а лигандом в этом определении является ион металла.
Рекомендации
- ^ Клотц, И.М. (1997). Энергетика лиганд-рецепторов: руководство для недоумевших. Вайли. ISBN 978-0-471-17626-8.
- ^ Форман, J.C .; Йохансен, Т., ред. (2003). Учебник рецепторной фармакологии (2-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8493-1029-4.
- ^ Уокер, М .; Шах, Х.Х. (1997). Все, что вам нужно знать о хелатной терапии (4-е изд.). New Canaan, Conn .: Keats Pub. ISBN 978-0-87983-730-3.
- ^ Железоселективные хелаторы с терапевтическим потенциалом в Hider, Роберт C .; Конг, Сяоле (2013). «Глава 8. Железо: эффект перегрузки и дефицита». В Астрид Сигель, Гельмут Сигель и Роланд К. О. Сигель (ред.). Взаимосвязь между ионами эссенциальных металлов и заболеваниями человека. Ионы металлов в науках о жизни. 13. Дордрехт: Спрингер. С. 229–294. Дои:10.1007/978-94-007-7500-8_8. ISBN 9789400774995. PMID 24470094.
- ^ Миллер, Марвин Дж. (1989). «Синтезы и терапевтический потенциал сидерофоров и аналогов на основе гидроксамовой кислоты». Химические обзоры. 89 (7): 1563–1579. Дои:10.1021 / cr00097a011.
- ^ Ahrland, S .; Chatt, J .; Дэвис, Н. (1958). «Относительное сродство атомов лиганда к акцепторным молекулам и ионам». Кварта. Rev. 12 (3): 265–276. Дои:10.1039 / QR9581200265.
- ^ Фаркас, Этелька; Бугльо, Петер (2017). «Глава 8. Свинец (II) комплексы аминокислот, пептидов и других родственных лигандов, представляющих биологический интерес». В Astrid, S .; Helmut, S .; Сигель, Р. К. О. (ред.). Свинец: его влияние на окружающую среду и здоровье. Ионы металлов в науках о жизни. 17. Берлин, Бостон: де Грюйтер. С. 201–240. Дои:10.1515/9783110434330-008. ISBN 9783110434330. PMID 28731301.
- ^ Скуг, Д.А.; West, D.M .; Holler, J.F .; Крауч, С. (2004). Основы аналитической химии (8-е изд.). Томсон Брукс / Коул. ISBN 978-0-03-035523-3. Раздел 30E
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "коэффициент селективности, kА / Б в ионообменной хроматографии". Дои:10.1351 / goldbook.S05566.html
- ^ Rice, N.M .; Ирвинг, Х. М. Н. Х .; Леонард, М.А. (1993). «Номенклатура распределения жидкость-жидкость (экстракция растворителем)». Pure Appl. Chem. ИЮПАК. 65 (11): 2373–2396. Дои:10.1351 / pac199365112373.
- ^ Rydberg, J .; Musikas, C; Чоппин, Г. Р., ред. (2004). Принципы и практика экстракции растворителем ( (2-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8247-5063-3.
- ^ Buck, R.P .; Линдер, Э. (1994). «Рекомендации по номенклатуре ионоселективных электродов». Pure Appl. Chem. ИЮПАК. 66 (12): 2527–2536. Дои:10.1351 / Pac199466122527.
- ^ Флоринель-Габриэль Бэника, Химические сенсоры и биосенсоры: основы и приложения, Джон Вили и сыновья, Чичестер, 2012, печать ISBN 978-0-470-71066-1
- ^ Кэтролл, Р.В. (1997). Химические сенсоры. Издательство Оксфордского университета. ISBN 978-0-19-850090-2.
![{ displaystyle { ce {{A} + B <=> AB; { mathit {K}} _ {AB} = { frac {[AB]} {[A] [B]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66c8b6d30bca33bf83d8b6d3125e0017b14896df)
![{ displaystyle { ce {{A} + C <=> AC; { mathit {K}} _ {AC} = { frac {[AC]} {[A] [C]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90f08f540ba07091047ede3f67d93ae37a54c512)

![{ displaystyle { ce {{AB} + C <=> {AC} + B; { mathit {K}} _ {B, C} = { frac {[AC] [B]} {[AB] [C]}} = { frac {{ mathit {K}} _ {AC} [A] [B] [C]} {{ mathit {K}} _ {AB} [A] [B] [ C]}} = { frac {{ mathit {K}} _ {AC}} {{ mathit {K}} _ {AB}}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02cfde6d3068bc904e109ff7d6f181821a4c2b57)