WikiDer > Бороксин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,4,6-тригидрокси-1,3,5,2,4,6-триоксатриборинан | |
| Другие имена Тригидроксибороксин, циклотрибороксан | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| B3ЧАС3О3 | |
| Молярная масса | 83,455 г моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Бороксин (B3ЧАС3О3) является 6-членным, гетероциклическое соединение состоит из чередующихся кислород и однократно гидрогенизированные бор атомы. Производные бороксина (бороновая ангидриды), такие как триметилбороксин и трифенилбороксин, также составляют более широкий класс соединений, называемых бороксинами.[1] Эти соединения представляют собой твердые вещества, которые обычно находятся в равновесии со своими соответствующими бороновые кислоты при комнатной температуре.[1][2][3] Помимо использования в теоретических исследованиях, бороксин в основном используется в производстве оптики.[4]
Структура и склеивание
Трехкоординатные соединения бора обычно имеют тригональную плоскую геометрию, поэтому бороксиновое кольцо также заблокировано в плоской геометрии.[2][5] Эти соединения изоэлектронны бензолу. При наличии вакантной p-орбитали на атомах бора они могут иметь некоторый ароматический характер.[2][6] Одинарные связи бора в соединениях бороксина в основном имеют s-характер.[5] Этилзамещенный бороксин имеет длину связи B-O 1,384 Å и длину связи B-C 1,565 Å.[6] Фенилзамещенный бороксин имеет аналогичные длины связи 1,386 Å и 1,546 Å соответственно, показывая, что заместитель оказывает небольшое влияние на размер бороксинового кольца.[6]
Замещения на бороксиновом кольце определяют его кристаллическую структуру. Алкилзамещенные бороксины имеют простейшую кристаллическую структуру. Эти молекулы накладываются друг на друга, выравнивая атом кислорода одной молекулы с атомом бора в другой, оставляя каждый атом бора между двумя другими атомами кислорода. Это формирует трубку из отдельных бороксиновых колец. Межмолекулярное расстояние B-O этилзамещенного бороксина составляет 3,462 Å, что намного больше, чем расстояние связи B-O, равное 1,384 Å. Кристаллическая структура фенилзамещенного бороксина более сложна. Взаимодействие между вакантными p-орбиталями в атомах бора и π-электронами в ароматических фенильных заместителях вызывает различную кристаллическую структуру. Бороксиновое кольцо одной молекулы уложено между двумя фенильными кольцами других молекул. Такое расположение позволяет фенильным заместителям отдавать π-электронную плотность вакантным р-орбиталям бора.[6]
Синтез
Как было обнаружено в 1930-х годах, бороксины производятся из соответствующих им бороновых кислот путем дегидратации.[1][2][3] Это обезвоживание может быть выполнено либо с помощью осушителя, либо путем нагревания в высоком вакууме.[2] Более поздний синтез триметилбороксина включает реакцию монооксид углерода с боран (B2ЧАС6) и борогидрид лития (LiBH4) в качестве катализатора:[5]
Реакции
Триметилбороксин используется при метилировании различных арилгалогенидов посредством палладийкатализированный Муфта Сузуки-Мияура реакции:[7]
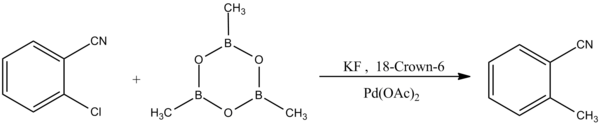
Другая форма реакции сочетания Сузуки-Мияуры проявляет селективность к арилхлоридам:[8]
Бороксины также были исследованы как предшественники мономерных оксоборан, HB≡O.[3] Это соединение быстро превращается обратно в циклический бороксин даже при низких температурах.[3]
Рекомендации
- ^ а б c Браун, Х.С. Бораны в органической химии; Издательство Корнельского университета: Итака, 1972; С. 346–347.
- ^ а б c d е Холл, Деннис Г. (2005). Бороновые кислоты - получение и применение в органическом синтезе и медицине. Джон Уайли и сыновья ISBN 3-527-30991-8.
- ^ а б c d Весткотт, С.А. (2010). «БОХИМИЯ замыкает круг». Angewandte Chemie International Edition. 49 (48): 9045–9046. Дои:10.1002 / anie.201003379. PMID 20878818.
- ^ Wu, Q.G .; Г. Ву; Л. Леон Бранка; С. Ван (1999). «B3O3Ph3 (7-азаиндол): структура, люминесценция и текучесть». Металлоорганические соединения. 18 (13): 2552–2556. Дои:10.1021 / om990053t.
- ^ а б c Онак, Т. в Органоборановая химия; Maitles, P.M., Stone, F.G.A., West, R., Eds .; Academic Press: Нью-Йорк, 1975; С. 2,4,16,44.
- ^ а б c d Haberecht, M.C .; Болте, Майкл; Вагнер, Матиас; Лернер, Ханс-Вольфрам (2005). "Новый полиморф Tri (п-толил) бороксин ». Журнал химической кристаллографии. 35 (9): 657–665. Дои:10.1007 / s10870-005-3325-у.
- ^ Серый, М .; Andrews, I.P .; Крюк, Д.Ф .; Kitteringham, J .; Войл, М. (2000). «Практическое метилирование арилгалогенидов сочетанием Судзуки-Мияура». Тетраэдр. 41 (32): 6237–6240. Дои:10.1016 / S0040-4039 (00) 01038-8.
- ^ Песня, C .; Май.; Chai, Q .; Ma, C .; Jaing, W .; Андрус, М. (2005). «Катализированное палладием взаимодействие Сузуки-Мияура с арилхлоридами с использованием объемного фенантрил-N-гетероциклического карбенового лиганда». Тетраэдр. 61 (31): 7438–7446. Дои:10.1016 / j.tet.2005.05.071.
![{displaystyle {ce {3CO}} + 1.5 overbrace {{ce {B2H6}}} ^ {{ce {borane}}} {ce {-> [{ce {LiBH4}}] (CH3BO) 3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ee286ea4c51b8daa42b23978ee38f50f525d2e8)
![{displaystyle {ce {{overset {(X = Br, I)} {C6H5X}} + (CH3BO) 3 -> [{ce {K2CO3, Pd (PPh3) 4}}] [{ce {dioxane}}] C6H5CH3 }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e07d87468caf83dee3007f299bb75ed8928deb4b)