WikiDer > Карбениевый ион
А ион карбения это положительный ион со структурой RR′R ″ C+, это химические вещества с трехвалентный углерод, имеющий +1 официальное обвинение.
В более ранней литературе имя ион карбония использовался для этого класса, но теперь он относится исключительно к другому семейству карбокатионы, то ионы карбония, где заряженный углерод пятивалентный.[1] Текущие определения были предложены химиком. Джордж Эндрю Олах в 1972 г.,[2] и теперь широко приняты.
Ионы карбения, как правило, обладают высокой реакционной способностью из-за неполной октет электронов; однако некоторые ионы карбения, такие как тропилий ion, относительно стабильны из-за делокализации положительного заряда между атомами углерода.
Номенклатура
Ионы карбения классифицируются как начальный, вторичный, или же высшее в зависимости от того, составляет ли число атомов углерода, связанных с ионизированным углеродом, 1, 2 или 3. (Ионы с нулевым углеродом, присоединенные к ионизированному углероду, такие как метений, CH+
3, обычно входят в основной класс).
Реактивность
Стабильность обычно увеличивается с увеличением количества алкильные группы связаны с несущим заряд углеродом. Третичные карбокатионы более стабильны (и образуются легче), чем вторичные карбокатионы, поскольку они стабилизируются сверхсопряжение. Первичные карбокатионы очень нестабильны. Следовательно, такие реакции, как SN1 реакция и E1 реакция элиминации обычно не возникают, если образуется первичный карбений.
Однако углерод, дважды связанный с ионизированным углеродом, может стабилизировать ион за счет резонанс. Такие катионы, как аллил катион, CH
2= CH – CH+
2, а бензил катион, C
6ЧАС
5–CH+
2, более стабильны, чем большинство других карбокатионов. Особенно реакционноспособны молекулы, которые могут образовывать аллил или бензилкарбений. Ионы карбения также могут быть стабилизированы гетероатомы.[3]
Ионы карбения могут подвергаться реакции перегруппировки от менее стабильных структур к столь же стабильным или более стабильным с константы скорости более 109 s−1. Этот факт усложняет пути синтеза многих соединений. Например, когда пентан-3-ол нагревают с водным HCl, первоначально образовавшийся 3-пентилкарбокатион перестраивается в статистическую смесь 3-пентила и 2-пентила. Эти катионы реагируют с ионом хлорида с образованием около1⁄3 3-хлорпентан и2⁄3 2-хлорпентан.
Типы ионов карбения
Ионы алкилия
Ионы карбения могут быть получены непосредственно из алканы удалив гидрид анион, ЧАС−
, с сильной кислотой. Например, волшебная кислота, смесь пентафторид сурьмы (SbF
5) и фтористоводородная кислота (FSO
3ЧАС), повороты изобутан в триметилкарбениевый катион, (CH
3)
3C+
.[4]
Ароматические ионы карбения
В ион тропилия является ароматный виды с формулой C
7ЧАС+
7.[5] Его название происходит от молекулы тропин (сам назван в честь молекулы атропин). Соли катиона тропилия могут быть стабильными, например тетрафторборат тропилия. Его можно сделать из циклогептатриен (тропилиден) и бром или же пентахлорид фосфора[6]
Это планарный, циклический, семиугольный ион; он также имеет 6 π-электронов (4п + 2, где п = 1), что выполняет Правило Хюккеля ароматичности. Он может координироваться как лиганд к металл атомы.
Показанная структура состоит из семи резонансные участники в котором каждый углерод несет часть положительного заряда.
В 1891 г. Г. Мерлинг получил водорастворимую соль реакцией циклогептатриена и брома.[7] Структура была выяснена Эггерс Деринг и Нокс в 1954 году.[8][9]
Другой ароматический ион карбения - это циклопропенил или циклопропениевый ион, C
3ЧАС+
3, полученный Рональдом Бреслоу и Джоном Т. Гровсом в 1970 году.[10] Хотя этот ион карбения менее стабилен, чем катион тропилия, он также может образовывать соли при комнатной температуре. Бреслоу и Гровс обнаружили, что растворы таких солей обладают спектроскопическими и химическими свойствами, соответствующими ожиданиям для ароматического иона карбения.
Трифенилметил (тритил) катион
В трифенилкарбений или трифенилметильный катион, [C (C
6ЧАС
5)
3]+
, особенно стабильна, потому что положительный заряд может быть распределен между 10 атомами углерода (3 атома углерода в орто и параграф положения каждой из трех фенильных групп плюс центральный атом углерода). Он существует в соединениях трифенилметилгексафторфосфат [C (C
6ЧАС
5)
3]+
[ПФ
6]−
, трифенилметилтетрафторборат [C (C
6ЧАС
5)
3]+
[BF
4]−
, и трифенилметил перхлорат [C (C
6ЧАС
5)
3]+
[ClO
4]−
.[11] Его производные включают триарилметановые красители.
Ионы арения

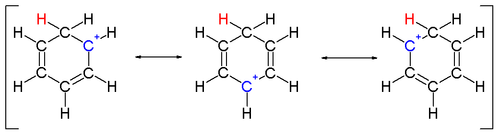
An арений ион представляет собой циклогексадиенильный катион, который появляется как реакционноспособный промежуточный продукт в электрофильное ароматическое замещение.[12] По историческим причинам этот комплекс также называют Веланд промежуточный,[13] или σ-комплекс.
Два атома водорода, связанные с одним углеродом, лежат в плоскости, перпендикулярной бензольному кольцу.[14] Ион арения больше не является ароматическим веществом; однако он относительно стабилен из-за делокализации: положительный заряд делокализован на 5 атомов углерода через π система, как показано на следующем резонансные структуры:
Другим вкладом в стабильность ионов арения является выигрыш в энергии в результате прочной связи между бензолом и комплексным электрофилом.
Самый маленький ион арения протонирован бензол, C
6ЧАС+
7. В бензиновый ион может быть выделен как стабильное соединение, когда бензол протонируется карборана суперкислота, H (CB11H (CH3)5Br6).[15] Бензолевая соль кристаллическая с термической стабильностью до 150 ° C. Длина скрепления выведено из Рентгеновская кристаллография согласуются со структурой циклогексадиенильного катиона.
Ионы ацилия
An ион ацилия катион с формулой RCO+.[16] Структура описывается как R − C≡O+ или R−= O. Это синтетический и реактивный эквивалент ацилкарбокатиона, но в реальной структуре кислород и углерод связаны тройной связью. Такие частицы являются обычными реактивными интермедиатами, например, в Ацилирование Фриделя-Крафтса также во многих других органические реакции такой как Перестановка Хаяши. Соли, содержащие ионы ацилия, могут быть получены путем удаления галогенида из ацилгалогениды:
- RCOCl + SbCl5 → RCO+SbCl−
6
Расстояние C – O в этих катионах составляет около 1,1 Ангстремс, даже короче, чем в монооксид углерода.[17] Катионы ацилия представляют собой характерные фрагменты, наблюдаемые в EI-масс-спектры из кетоны.
Смотрите также
Рекомендации
- ^ Золотая книга ИЮПАК ион карбония
- ^ «Стабильные карбокатионы. CXVIII. Общая концепция и структура карбокатионов, основанная на дифференциации трехвалентных (классических) ионов карбения от трехцентров связанных пента- или четырехкоординированных (неклассических) ионов карбония. Роль карбокатионов в электрофильных реакциях». Джордж Эндрю Олах; Варенье. Chem. Soc.; 1972; 94(3); 808–820.
- ^ Хансйорг Грюцмахер, Кристина М. Марчанд (1997), «Ионы карбения, стабилизированные гетероатомом», Coord. Chem. Ред., 163, 287–344. Дои:10.1016 / S0010-8545 (97) 00043-X
- ^ Джордж А. Олах и Иоахим Лукас (1967), "Стабильные ионы карбония. XLVII. Образование иона алкилкарбония из алканов посредством отщепления гидрид (алкид) иона в растворе фторсульфоновой кислоты-пентафторида сурьмы-сульфурилхлорфторида". Варенье. Chem. Soc. 89 (18), 4739–4744 Дои:10.1021 / ja00994a030
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "молекула". Дои:10.1351 / goldbook.M04002
- ^ «Тропилий тетрафторат» Organic Syntheses, Coll. Vol. 5, стр.1138 (1973); Vol. 43, стр.101 (1963). связь В архиве 2012-08-29 в Wayback Machine
- ^ Мерлинг, Г. (1891), «Убер Тропин». Berichte der deutschen chemischen Gesellschaft, 24: 3108–3126. Дои:10.1002 / cber.189102402151
- ^ «Циклогептатриенилий (Тропилий) Ион» В. фон Э. Деринг, Л. Х. Нокс Варенье. Chem. Soc., 1954, 76 (12), стр 3203–3206 Дои:10.1021 / ja01641a027
- ^ «Ароматичность как краеугольный камень химии гетероциклов» Александру Т. Балабан, Даниэла К. Оничиу, Алан Р. Катрицки Chem. Ред., 2004, 104 (5), 2777–2812 Дои:10.1021 / cr0306790
- ^ «Циклопропенильный катион. Синтез и характеристика». Р. Бреслоу и Дж. Т. Гровс Варенье. Chem. Soc. , 1970, 92 (4), 984–987 [1]
- ^ Н. С. Дено, Дж. Дж. Ярузельски и Алан Шрисхайм (1955) «Ионы карбония. I. Функция кислотности (C0), полученный из арилкарбониевых ионных равновесий ". Варенье. Chem. Soc., 77 (11), 3044–3051. Дои:10.1021 / ja01616a036
- ^ «Стабильные карбокатионы. CXVIII. Общая концепция и структура карбокатионов, основанная на дифференциации трехвалентных (классических) ионов карбения от трехцентров связанных пента- или четырехкоординированных (неклассических) ионов карбония. Роль карбокатионов в электрофильных реакциях» Джордж А. Олах Варенье. Chem. Soc.; 1972; 94(3) 808–820; Дои:10.1021 / ja00758a020
- ^ "Квантово-механическое исследование ориентации заместителей в ароматических молекулах" Дж. У. Веланд Варенье. Chem. Soc.; 1942; 64(4) 900–908; Дои:10.1021 / ja01256a047
- ^ Справочник по механизму в органической химии, Питер Сайкс; стр 130–133
- ^ «Выделение бензин-ионных солей» Кристофер А. Рид, Ки-Чан Ким, Евгений С. Стоянов, Даниэль Стаско, Фук С. Там, Леонард Дж. Мюллер и Питер Д. У. Бойд Варенье. Chem. Soc.; 2003; 125(7) 1796–1804; Дои:10.1021 / ja027336o
- ^ Сборник химической терминологии, ацильные группы
- ^ Chevrier, B .; Le Carpentier, J.M .; Вайс, Р. (1972). "Синтез двух кристаллических разновидностей промежуточного пентахлорида сурьмы Фриделя-Крафтсап-толуоилхлорид. Кристаллические структуры донорно-акцепторного комплекса и ионной соли ». Варенье. Chem. Soc. 94 (16): 5718–5723. Дои:10.1021 / ja00771a031.