WikiDer > Ацилгалогенид
An ацилгалогенид (также известный как галогенид кислоты) это химическое соединение полученный из оксокислота[1] заменив гидроксил группа с галогенид группа.[2]
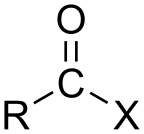
Если кислота карбоновая кислота, соединение содержит –COX функциональная группа, который состоит из карбонил группа, единолично связанная с галоген атом. Общую формулу такого ацилгалогенида можно записать RCOX, где R может быть, например, алкил группа, CO представляет собой карбонильную группу, и X представляет собой галогенид, такой как хлористый. Ацилхлориды являются наиболее часто встречающимися ацилгалогенидами, но ацетил иодид это тот, который производится (временно) в самых крупных масштабах. Миллиарды килограммов ежегодно генерируются при производстве уксусная кислота.[3]
Гидроксильная группа сульфоновая кислота также может быть заменен галогеном для получения соответствующего сульфонилгалогенида. На практике это почти всегда хлорид, обеспечивающий сульфонилхлорид.
Подготовка
Алифатические ацилгалогениды
В промышленных масштабах реакция уксусный ангидрид с участием хлористый водород производит смесь ацетилхлорида и уксусной кислоты:[4]
- (CH3CO)2O + HCl → CH3COCl + CH3CO2ЧАС
Ключевой промышленный путь к пропионовый ангидрид включает термическое обезвоживание:
- 2 канала3CH2CO2H → (CH3CH2CO)2O + H2О
Другой маршрут - это Реппе карбонилирование из этилен с пропионовой кислотой и карбонил никеля в качестве катализатора:[5]
- CH2= CH2 + CH3CH2CO2H + CO → (CH3CH2CO)2О
Обычные синтезы ацилхлоридов также включают реакцию карбоновые кислоты с участием фосген, тионилхлорид,[6] и трихлорид фосфора[7] Пентабромид фосфора используется для ацилбромидов, которые редко представляют ценность.
Ароматические ацилхлориды
Бензоилхлорид получают из бензотрихлорид с использованием воды или бензойной кислоты:[8]
- C6ЧАС5CCl3 + H2О → С6ЧАС5COCl + 2 HCl
- C6ЧАС5CCl3 + C6ЧАС5CO2H → 2 С6ЧАС5COCl + HCl
Как и в случае с другими ацилхлориды, он может быть получен из исходной кислоты и других хлорирующих агентов. пентахлорид фосфора или тионилхлорид.
Репрезентативные лабораторные маршруты к ароматный ацилгалогениды сравнимы с алифатическими ацилгалогенидами.[9] Например, хлороформилирование, конкретный тип Ацилирование Фриделя-Крафтса который использует формальдегид как реагент[нужна цитата], или прямое хлорирование из бензальдегид производные.[10]
Ацилфториды
Коммерческий интерес, ацилхлориды реагировать с HF, чтобы дать ацил фториды.[11] Ароматические (а также алифатические) ацилфториды удобно получать непосредственно из карбоновых кислот с использованием стабильных недорогих химических продуктов: PPh3, NBS и Et3N-3HF в настольном протоколе.[12] Циануровый фторид превращает карбоновые кислоты в ацилфториды.
Реакции
Ацилгалогениды представляют собой довольно реакционноспособные соединения, которые часто синтезируют для использования в качестве промежуточных продуктов при синтезе других органических соединений. Например, ацилгалогенид может реагировать с участием:
- воды, чтобы сформировать карбоновая кислота. Этот гидролиз является наиболее часто используемой реакцией ацилгалогенидов, поскольку он происходит в промышленном синтезе уксусная кислота.
- ан алкоголь сформировать сложный эфир
- ан ароматическое соединение, с помощью Кислота Льюиса катализатор, такой как AlCl3, чтобы сформировать ароматический кетон.[7] Увидеть Ацилирование Фриделя-Крафтса.
- карбоновые кислоты с образованием ангидриды органических кислот.[13]
В указанных выше реакциях HX (галогенид водорода или галогеноводородная кислота). Например, если ацилгалогенид представляет собой ацилхлорид, HCl (хлористый водород или соляная кислота) тоже образуется.
Множественные функциональные группы
Молекула может иметь более одной ацилгалогенидной функциональной группы. Например, «адипоил дихлорид», обычно называемый просто адипоилхлорид, имеет два ацилхлорида функциональные группы; см. структуру справа. Это дихлорид (т.е. двойной хлорид) 6-углеродной дикарбоновой кислоты. адипиновая кислота. Важным применением адипоилхлорида является полимеризация с органическим диамино-соединением с образованием полиамида, называемого нейлон или полимеризация с некоторыми другими органическими соединениями с образованием полиэфиры.
Фосген (карбонилдихлорид, Cl – CO – Cl) - очень токсичный газ, являющийся дихлоридом угольная кислота (HO – CO – OH). Оба хлоридных радикала в фосгене могут вступать в реакции, аналогичные предыдущим реакциям ацилгалогенидов. Фосген используется в качестве реагента при производстве поликарбонат полимеры, среди прочего промышленного применения.
Общие опасности
Летучие ацилгалогениды слезотечение потому что они могут вступать в реакцию с водой на поверхности глаза с образованием галогеноводородных и органических кислот, раздражающих глаза. Подобные проблемы могут возникнуть при вдыхании паров ацилгалогенидов. Как правило, ацилгалогениды (даже нелетучие соединения, такие как тозилхлорид) находятся раздражители к глазам, коже и слизистые оболочки.
использованная литература
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "ацильные группы". Дои:10.1351 / goldbook.A00123
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "ацилгалогениды". Дои:10.1351 / goldbook.A00124
- ^ Осия Чунг, Робин С. Танке, Дж. Пол Торренс «Уксусная кислота» в Энциклопедии промышленной химии Ульмана 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a01_045
- ^ Чунг, Осия; Танке, Робин С .; Торренс, Дж. Пол (2000). "Уксусная кислота". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a01_045.
- ^ Самель, Ульф-Райнер; Колер, Вальтер; Геймер Армин Отто; Кеузер, Ульрих (2005). «Пропионовая кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_223.
- ^ Helferich, B .; Шефер, В. (1929). «н-бутирл хлорид». Органический синтез. 9: 32. Дои:10.15227 / orgsyn.009.0032.
- ^ а б Allen, C.F.H .; Баркер, У. Э. (1932). «Дезоксибензоин». Органический синтез. 12: 16. Дои:10.15227 / orgsyn.012.0016.
- ^ Маки, Такао; Такеда, Кадзуо (2000). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_555.
- ^ Адамс, Роджер (1923). «п-Нитробензоилхлорид». Органический синтез. 3: 75. Дои:10.15227 / orgsyn.003.0075.
- ^ Clarke, H.T .; Тейлор, Э. Р. (1929). «о-Хлорбензоилхлорид». Органический синтез. 9: 34. Дои:10.15227 / orgsyn.009.0034.
- ^ Олах Г., Кун С. (1961). «Получение ацилфторидов с безводным фтористым водородом. Общее использование метода Колсона и Фреденхагена». J. Org. Chem. 26: 237–238. Дои:10.1021 / jo01060a600.
- ^ Munoz, Socrates B .; Данг, Хуонг; Испизуа-Родригес, Ксанат; Мэтью, Томас; Пракаш, Г. К. Сурья (2019-03-15). «Прямой доступ к ацилфторидам из карбоновых кислот с использованием системы реагентов для дезоксифторирования фосфина / фторида». Органические буквы. 21 (6): 1659–1663. Дои:10.1021 / acs.orglett.9b00197. ISSN 1523-7060.
- ^ Allen, C.F.H .; Kibler, C.J .; McLachlin, D.M .; Уилсон, К. В. (1946). «Ангидриды кислот». Органический синтез. 26: 1. Дои:10.15227 / orgsyn.026.0001.
внешние ссылки
| В Викицитатнике есть цитаты, связанные с: Ацилгалогенид |