WikiDer > Карбоксимидат
Карбоксимидаты (или более общий имидаты) являются органическими соединениями, которые можно рассматривать как сложные эфиры сформированный между карбоксимидовая кислота (R-C (= NR ') OH) и алкоголь, с общей формулой R-C (= NR ') OR ".
Они также известны как иминоэфиры, так как они напоминают имины (> C = N-) с атомом кислорода, связанным с атомом углерода.
Синтез
Имидаты могут быть получены несколькими синтетическими путями,[1] но в целом сформированы Пиннер реакция. Это происходит через катализируемую кислотой атаку нитрилов спиртами.

Полученные таким образом имидаты образуются в виде их гидрохлоридных солей, которые иногда называют солями Пиннера. Карбоксимидаты также образуются как промежуточные соединения в Мумия перестановка и Перестройка сверхчеловека.
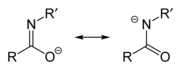
Имидат / амидат анионы
An амидат / имидат анион образуется на депротонирование из амид или же имидовая кислота. Поскольку амиды и имидные кислоты являются таутомеры, при депротонировании они образуют один и тот же анион. Таким образом, два имени являются синонимами, описывающими один и тот же анион, хотя, возможно, имидат относится к участнику резонанса слева, а амидат относится к участнику резонанса справа. Однако их различают, когда они действуют как лиганды для переходных металлов, с O-связанные виды, называемые имидатами и N-связанные виды, называемые амидатами. Их можно рассматривать как азазамещенные аналоги енолирует с формулой R-N = C (O−)Р.
Реакции
Карбоксимидаты хороши электрофилы и претерпевают ряд реакций присоединения; с алифатический имидаты обычно реагируют быстрее, чем ароматный имидаты.[1] Они могут быть гидролизованный давать сложные эфиры и аналогичным способом реагирует с аминами (включая аммиак) с образованием амидины. Алифатические имидаты реагируют с избытком спирта при кислотном катализе с образованием ортоэфиры RC (ИЛИ)3ароматические имидаты также могут быть преобразованы, но гораздо менее легко.
Перестановка Чепмена
Названный в честь Артур Уильям Чепмен, кто первым описал это,[3] это термическое превращение арил N-арилбензимидатов в соответствующие амиды.[4] Концептуально он похож на Перегруппировка Ньюмана – Кварта.
Как защитная группа
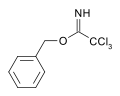
Карбоксимидаты могут действовать как защитная группа для спиртов.[5] Например, катализируемая основанием реакция бензиловый спирт на трихлорацетонитрил дает трихлорацетимидат. Этот вид имеет ортогональную стабильность к ацетату и TBS защиты и может быть расщеплен кислотным гидролизом.[6]
Смотрите также
- Амидины
- Сложные эфиры
- Оксазолин - соответствующий 5-членный гетероцикл
Рекомендации
- ^ а б Роджер, Роберт; Нилсон, Дуглас Г. (1961). «Химия имидатов». Химические обзоры. 61 (2): 179–211. Дои:10.1021 / cr60210a003.
- ^ Б. П. Манди, М. Г. Эллерд, Ф. Г. Фавалоро: Назовите реакции и реагенты в органическом синтезе, 2. Auflage, Wiley-Interscience, Хобокен, Нью-Джерси. 2005, ISBN 978-0-471-22854-7, С. 516.
- ^ Чепмен, Артур Уильям (1925). «CCLXIX. - Иминоариловые эфиры. Часть III. Молекулярная перегруппировка N-фенилбензимнофенилового эфира». J. Chem. Soc., Trans. 127 (0): 1992–1998. Дои:10.1039 / CT9252701992.
- ^ Schulenberg, J. W .; Арчер, С. (1965). «Перестановка Чепмена». Орг. Реагировать. 14. Дои:10.1002 / 0471264180.or014.01.
- ^ Wuts, Питер Г. М .; Грин, Теодора В. (2006). Защитные группы в органическом синтезе (4-е изд.). Хобокен, штат Нью-Джерси: ВИЛИ. п. 244. ISBN 978-0-471-69754-1.
- ^ Ю, Бяо; Ю, Хай; Хуэй Юнчжэн; Хан, Сювэнь (июнь 1999 г.). «Трихлорацетимидат как эффективная защитная группа для спиртов». Synlett. 1999 (6): 753–755. Дои:10.1055 / с-1999-2736.