WikiDer > Муфта Кастро – Стивенса
| Муфта Кастро – Стивенса | |
|---|---|
| Названный в честь | Чарльз Э. Кастро Роберт Д. Стивенс |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000525 |
В Муфта Кастро – Стивенса это реакция кросс-сочетания между ацетилид меди (I) и арилгалогенид в пиридин, образуя дизамещенный алкин и галогенид меди (I).[1][2]
Реакция была открыта в 1963 г. Калифорнийский университет, Риверсайд химики Кастро и Стивенс[1][2] и используется как инструмент в органический синтез органических соединений. Реакция имеет сходство с гораздо более старыми Синтез Розенмунда – фон Брауна (1914)[3][4] между арилгалогенидами и цианид меди (I) и сам был модифицирован в 1975 году с Муфта Соногашира добавлением палладиевого катализатора и приготовлением медноорганическое соединение на месте, что позволяет каталитически использовать медь.[5][6]
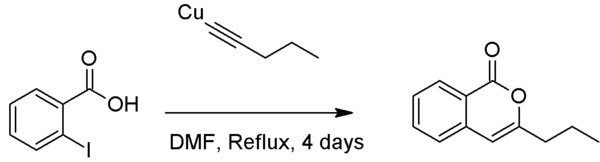
Типичная реакция - это сочетание йодобензол с ацетилидом меди фенилацетилен в рефлюкс пиридин к дифенилацетилен:[1]
В отличие от сочетания Соногашира, сочетание Кастро-Стефенса может давать гетероциклические соединения, когда нуклеофильная группа орто к арилгалогениду, хотя для этого обычно требуется диметилформамид (ДМФ) в качестве растворителя.[7][8]
Рекомендации
- ^ а б c Stephens, R.D .; Кастро, К. Э. (1963). «Замена арил йодидов ацетилидами меди. Синтез толанов и гетероциклов». J. Org. Chem. 28 (12): 3313–3315. Дои:10.1021 / jo01047a008.
- ^ а б Owsley, D.C .; Кастро, К. Э. (1972). "Замена арилгалогенидов ацетилидами меди (I): 2-фенилфуро [3,2-б] пиридин ". Органический синтез. 52: 128. Дои:10.15227 / orgsyn.052.0128.; Коллективный объем, 6, п. 916
- ^ Розенмунд, Карл В.; Удар, Эрих (1919). "Das am Ringkohlenstoff gebundene Halogen und sein Ersatz durch andere Substituenten. I. Mitteilung: Ersatz des Halogens durch die Carboxylgruppe" [Галоген, связанный с углеродом кольца, и его замена другими заместителями. I. Примечание: Замена галогена карбоксильной группой]. Бер. Dtsch. Chem. Ges. А / Б (на немецком). 52 (8): 1749–1756. Дои:10.1002 / cber.19190520840.
- ^ фон Браун, Юлий; Манц, Готфрид (1931). "Fluoranthen und seine Derivate. III. Mitteilung" [Флуорантен и его производные. III. Уведомление]. Justus Liebigs Ann. Chem. (на немецком). 488 (1): 111–126. Дои:10.1002 / jlac.19314880107.
- ^ Соногашира, Кенкичи; Тохда, Ясуо; Хагихара, Нобуэ (1975). «Удобный синтез ацетиленов: каталитические замещения ацетиленового водорода бромалкенами, йодаренами и бромпиридинами». Tetrahedron Lett. 16 (50): 4467–4470. Дои:10.1016 / с0040-4039 (00) 91094-3.
- ^ Соногашира, Кенкичи (2002). "Разработка катализируемого Pd-Cu кросс-сочетания концевых ацетиленов с sp2-галогениды углерода ». J. Organomet. Chem. 653 (1–2): 46–49. Дои:10.1016 / s0022-328x (02) 01158-0.
- ^ Бату, Гюнес; Стивенсон, Роберт (1980). «Синтез природных изокумаринов, артемидина и 3-пропилизокумарина». J. Org. Chem. 45 (8): 1532–1534. Дои:10.1021 / jo01296a044.
- ^ Кастро, Чарльз Э .; Havlin, R .; Honwad, V.K .; Malte, A.M .; Moje, Стив В. (1969). «Замещения меди (I). Объем и механизм замещения ацетилида меди». Варенье. Chem. Soc. 91 (23): 6464–6470. Дои:10.1021 / ja01051a049.
![Реакция Кастро – Стивенса {displaystyle {egin {align} {} {ce {Cu-C {Equiv} C-R '}} + {color {Red} {ce {RX}}} & {ce {-> [{ce {пиридин} }] CuX}} + {color {Red} {ce {R}} {-}} {ce {C {Equiv} C-R '}} {color {Red} {ce {X}}} & = { color {Red} {ce {I, Br, Cl}}} {color {Red} {ce {R}}} & = {color {Red} {ce {Ar}}} конец {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb20e472e272f9d2dd48aff4835d778853ac6182)