WikiDer > Дефектная мешающая частица
Дефектные мешающие частицы (DIP), также известный как дефектные мешающие вирусы, спонтанно генерируются вирус мутанты, у которых критическая часть генома частицы потеряна из-за дефектной репликации или негомологичная рекомбинация.[2][3] Предполагается, что механизм их образования является результатом переключения матрицы во время репликации вирусного генома, хотя также были предложены нерепликативные механизмы, включающие прямое лигирование фрагментов геномной РНК.[4][5] DIP происходят из родительского вируса и связаны с ним, а частицы классифицируются как DIP, если они становятся неинфекционными из-за потери или серьезного повреждения по крайней мере одного существенного гена вируса в результате дефекта.[6] DIP обычно может проникать в клетки-хозяева, но для этого требуется другая полнофункциональная вирусная частица (вирус-помощник). одновременно заражать ячейка с ним, чтобы обеспечить потерянные факторы.[7][8]
Впервые DIP были обнаружены еще в 1950-х годах фон Магнусом и Шлезингером, оба работали с вирусами гриппа.[9] Однако формализация терминологии DIP была осуществлена в 1970 году Хуангом и Балтимором, когда они заметили присутствие «коренастых» частиц вируса везикулярного стоматита на электронных микрофотографиях.[10] DIP могут встречаться практически в каждом классе ДНК- и РНК-вирусов как в клинических, так и в лабораторных условиях, включая полиовирус, SARS коронавирус, корь, альфавирусы, респираторно-синцитиальный вирус и вирус гриппа.[11][12][13][14][15][16][17][18]
Дезертирство
DIP - это естественное явление, которое можно воссоздать в лабораторных условиях, а также синтезировать для экспериментального использования. Они спонтанно создаются подверженными ошибкам вирусная репликация, что-то особенно распространенное в РНК-вирусах по сравнению с ДНК-вирусами из-за используемого фермента (репликазы или РНК-зависимая РНК-полимераза.)[6][19] Геномы DI обычно сохраняют концевые последовательности, необходимые для распознавания вирусными полимеразами, и последовательности для упаковки их генома в новые частицы, но мало что еще.[20][21] Размер события геномной делеции может сильно варьироваться, с одним из таких примеров в DIP, полученном из вируса бешенства, проявляющего делецию 6,1 т.п.н.[22] В другом примере размер геномов нескольких вирусов растений DI-ДНК варьировался от одной десятой размера исходного генома до половины.[23]
Вмешательство
Считается, что частицы мешают, если они влияют на функцию родительского вируса через конкурентное торможение[6] во время коинфекции. Другими словами, дефектные и исправные вирусы реплицируются одновременно, но когда количество дефектных частиц увеличивается, количество реплицированного исправного вируса уменьшается. Степень вмешательства зависит от типа и размера дефекта в геноме; большие делеции геномных данных позволяют быстро реплицировать дефектный геном.[20] Во время коинфекции клетки-хозяина в конечном итоге будет достигнуто критическое соотношение, при котором для производства неинфекционных DIP используется больше вирусных факторов, чем инфекционных частиц.[20] Также было продемонстрировано, что дефектные частицы и дефектные геномы стимулируют врожденные иммунные ответы хозяина, и их присутствие во время вирусной инфекции коррелирует с силой противовирусного ответа.[11]
Эта мешающая природа становится все более важной для исследований вирусной терапии.[24] Считается, что из-за своей специфичности DIP будут нацелены на сайты заражения. В одном примере ученые использовали DIP для создания «защищающих вирусов», которые ослабляли патогенность инфекции гриппа А у мышей до такой степени, что она перестала быть летальной.[25]
Патогенез
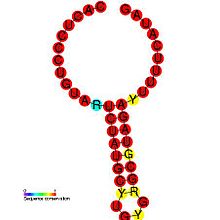
Было показано, что DIP играют роль в патогенезе некоторых вирусов. Одно исследование демонстрирует взаимосвязь между патогеном и его дефектным вариантом, показывая, как регулирование выработки DI позволяет вирусу ослаблять свою собственную инфекционную репликацию, снижая вирусную нагрузку и, таким образом, повышая его паразитарную эффективность, предотвращая слишком быструю смерть хозяина.[26] Это также дает вирусу больше времени для распространения и заражения новых хозяев. Генерация DIP регулируется вирусами: Цис-действующий элемент репликации коронавируса SL-III (показано на изображении) является геномной структурой более высокого порядка, участвующей в посредничестве продукции DIP в бычий коронавирус, с очевидными гомологами, обнаруженными в других коронавирус группы.[1] Более подробное введение можно найти в работе Алисы Хуанг и Дэвида Балтимора 1970 года.[27]
Типы дефектных геномов РНК
- Ошибки при удалении - это пропуск фрагмента шаблона. Примеры этого типа дефекта можно найти в вирусе пятнистого увядания томатов и вирусе Flock House.[28][29]
- Дефекты снэпбэков возникают, когда репликаза транскрибирует часть одной цепи, а затем использует эту новую цепь в качестве шаблона. В результате может получиться шпилька. Дефекты Snapback наблюдались в вирус везикулярного стоматита.[30]
- Дефекты плоской ручки - это когда полимераза несет частично сформированную нить, а затем переключается обратно, чтобы транскрибировать 5 'конец, формируя форму плоской ручки. У вирусов гриппа обнаруживаются дефекты попрошайничества.[31]
- Сложный отказ - это когда и удаление, и отказ от снэпбэка происходят вместе.
- Мозаичный или сложный геном DI, в котором различные области могут происходить из одного и того же генома вируса-помощника, но в неправильном порядке; из разных сегментов хелперного генома или могут включать сегменты РНК хозяина. Также могут происходить дублирования.[3]
Исследование
Вирусологи провели исследование, чтобы узнать больше о влиянии на инфицирование клеток-хозяев и о том, как геномы DI могут потенциально работать как противовирусные агенты.[3] В статье 2014 года описывается доклиническая работа по проверке их эффективности против вирусов гриппа.[32] Было также обнаружено, что DI-РНК способствуют инфицированию грибов вирусами семейства Partitiviridae впервые, что дает возможность для более междисциплинарной работы.[19]
Несколько инструментов как ViReMa[33] и DI-tector [34] были разработаны, чтобы помочь обнаружить дефектные вирусные геномы в данных секвенирования следующего поколения.
Рекомендации
- ^ а б Раман С., Баума П., Уильямс Г.Д., Брайан Д.А. (2003). «Стеблевая петля III в 5'-нетранслируемой области является цис-действующим элементом в бычьем коронавирусе, препятствующем репликации РНК». Дж. Вирол. 77 (12): 6720–30. Дои:10.1128 / jvi.77.12.6720-6730.2003. ЧВК 156170. PMID 12767992.
- ^ Белый, КА; Моррис, Т.Дж. (январь 1994 г.). «Негомологичная рекомбинация РНК в tombusviruses: генерация и эволюция дефектных интерферирующих РНК путем пошаговых делеций». Журнал вирусологии. 68 (1): 14–24. ЧВК 236259. PMID 8254723.
- ^ Патхак, КБ; Надь, PD (декабрь 2009 г.). «Дефектные интерферирующие РНК: враги вирусов и друзья вирусологов». Вирусы. 1 (3): 895–919. Дои:10.3390 / v1030895. ЧВК 3185524. PMID 21994575.
- ^ Гмыл, AP; Белоусов Э.В. Маслова С.В.; Хитрина, ЭВ; Четверин АБ; Агол В.И. (ноябрь 1999 г.). «Нерепликативная рекомбинация РНК в полиовирусе». Журнал вирусологии. 73 (11): 8958–65. ЧВК 112927. PMID 10516001.
- ^ а б c Патхак КБ, Надь П.Д. (2009). «Дефектные интерферирующие РНК: враги вирусов и друзья вирусологов». Вирусы. 1 (3): 895–919. Дои:10.3390 / v1030895. ЧВК 3185524. PMID 21994575.
- ^ Макино С., Шие С.К., Соэ Л.Х., Бейкер СК, Лай М.М. (1988). «Первичная структура и трансляция дефектной интерферирующей РНК коронавируса мыши». Вирусология. 166 (2): 550–60. Дои:10.1016/0042-6822(88)90526-0. ЧВК 7131284. PMID 2845661.
- ^ Палмер, С. (15 сентября 2011 г.). Оксфордский учебник зоонозов: биология, клиническая практика и контроль общественного здравоохранения (2-е изд.). Издательство Оксфордского университета. С. 399–400.
- ^ ГАРД, S; VON MAGNUS, P; СВЕДМЫРЬ, А; БЕРЧ-АНДЕРСЕН, А (1952). «Исследования седиментации вируса гриппа». Archiv für die Gesamte Virusforschung. 4 (5): 591–611. Дои:10.1007 / BF01242026. PMID 14953289.
- ^ Huang, AS; Балтимор, Д (25 апреля 1970 г.). «Дефектные вирусные частицы и процессы вирусного заболевания». Природа. 226 (5243): 325–7. Дои:10.1038 / 226325a0. PMID 5439728.
- ^ а б Солнце, Y; Джайн, D; Козиол-Уайт, CJ; Genoyer, E; Гилберт, М; Тапиа, К; Панеттьери Р.А. младший; Ходинка, Р.Л .; Лопес, CB (сентябрь 2015 г.). «Иммуностимулирующие дефектные вирусные геномы из респираторно-синцитиального вируса способствуют сильному врожденному противовирусному ответу во время заражения мышей и людей». Патогены PLOS. 11 (9): e1005122. Дои:10.1371 / journal.ppat.1005122. ЧВК 4559413. PMID 26336095.
- ^ Диммок, штат Нью-Джерси; Голубь, Б.К .; Скотт, PD; Meng, B; Тейлор, я; Cheung, L; Халлис, B; Marriott, AC; Кэрролл, МВт; Истон, AJ (2012). «Клонированный дефектный интерферирующий вирус гриппа защищает хорьков от пандемического вируса гриппа А 2009 г. и позволяет установить защитный иммунитет». PLOS ONE. 7 (12): e49394. Дои:10.1371 / journal.pone.0049394. ЧВК 3521014. PMID 23251341.
- ^ Сайра, К; Lin, X; DePasse, СП; Halpin, R; Twaddle, А; Стоквелл, Т; Ангус, Б; Коззи-Лепри, А; Дельфино, М; Дуган, V; Dwyer, DE; Фрайберг, М; Хорбан, А; Лоссо, М; Линфилд, Р. Вентворт, DN; Холмс, ЕС; Дэйви, Р. Вентворт, Делавэр; Ghedin, E; INSIGHT FLU002, исследование, группа .; INSIGHT FLU003 Исследование, группа. (Июль 2013). «Анализ последовательности in vivo дефектной интерферирующей РНК пандемического вируса гриппа A H1N1». Журнал вирусологии. 87 (14): 8064–74. Дои:10.1128 / JVI.00240-13. ЧВК 3700204. PMID 23678180.
- ^ Петтерсон, Э; Го, ТС; Evensen, Ø; Микалсен, А.Б. (2 ноября 2016 г.). «Экспериментальная рекомбинация РНК альфавируса рыб in vivo дает как жизнеспособный вирус, так и дефектную вирусную РНК». Научные отчеты. 6: 36317. Дои:10.1038 / srep36317. ЧВК 5090867. PMID 27805034.
- ^ Каттанео, Р. Шмид, А; Eschle, D; Бачко, К; ter Meulen, V; Биллетер, Массачусетс (21 октября 1988 г.). «Предвзятая гипермутация и другие генетические изменения дефектных вирусов кори при инфекциях головного мозга человека». Клетка. 55 (2): 255–65. Дои:10.1016/0092-8674(88)90048-7. ЧВК 7126660. PMID 3167982.
- ^ Макино, С; Йокомори, К; Лай, М.М. (декабрь 1990 г.). «Анализ эффективно упакованных дефектных интерферирующих РНК коронавируса мыши: локализация возможного сигнала упаковки РНК». Журнал вирусологии. 64 (12): 6045–53. ЧВК 248778. PMID 2243386.
- ^ Лундквист, RE; Салливан, М; Майзель Дж. В., младший (ноябрь 1979 г.). «Характеристика нового изолята дефектных интерферирующих частиц полиовируса». Клетка. 18 (3): 759–69. Дои:10.1016/0092-8674(79)90129-6. PMID 229964.
- ^ Стауффер Томпсон К.А., Ремпала Г.А., Инь Дж. (2009). «Многократное подавление инфекции дефектными мешающими частицами». J. Gen. Virol. 90 (Pt 4): 888–99. Дои:10.1099 / vir.0.005249-0. ЧВК 2889439. PMID 19264636.
- ^ а б Чиба С., Лин Й., Кондо Х, Канемацу С., Сузуки Н. (2013). «Влияние дефектной интерферирующей РНК на индукцию симптомов и репликацию нового партитивируса из фитопатогенного гриба Rosellinia necatrix». Дж. Вирол. 87 (4): 2330–41. Дои:10.1128 / JVI.02835-12. ЧВК 3571465. PMID 23236074.
- ^ а б c Dimmock, N.J .; Истон, А. Дж .; Леппард, К. Н. (2007), «13», Введение в современную вирусологию (6-е изд.), Оксфорд, Великобритания: Blackwell Publishing Ltd.
- ^ Resende Rde O, de Haan P, van de Vossen E, de Avila AC, Goldbach R, Peters D (1992). «Дефектные интерферирующие сегменты L РНК вируса пятнистого увядания томатов сохраняют оба конца генома вируса и имеют обширные внутренние делеции». J. Gen. Virol. 73 (10): 2509–16. Дои:10.1099/0022-1317-73-10-2509. PMID 1402797.
- ^ Конзельманн К.К., Кокс Дж. Х., Тиль Х. Дж. (1991). «L (полимераза) -дефицитная РНК интерферирующей частицы вируса бешенства реплицируется и транскрибируется гетерологичными белками L хелперного вируса». Вирусология. 184 (2): 655–63. Дои:10.1016 / 0042-6822 (91) 90435-э. PMID 1887588.
- ^ Patil, Basavaprabhu L .; Дасгупта, Индранил (2006). «Дефектные интерферирующие ДНК растительных вирусов». Критические обзоры в науках о растениях. 25 (1): 47–64. Дои:10.1080/07352680500391295.
- ^ Томпсон К.А., Инь Дж. (2010). «Динамика популяции РНК-вируса и его дефектных мешающих частиц в пассажных культурах». Virol. J. 7: 257. Дои:10.1186 / 1743-422X-7-257. ЧВК 2955718. PMID 20920247.
- ^ Истон А.Дж., Скотт П.Д., Эдворти Н.Л., Мэн Б., Марриотт А.С., Диммок, штат Нью-Джерси (2011). «Новое средство широкого спектра действия для лечения респираторных вирусных инфекций: дефектный интерферирующий вирус гриппа обеспечивает защиту от пневмовирусной инфекции in vivo» (PDF). Вакцина. 29 (15): 2777–84. Дои:10.1016 / j.vaccine.2011.01.102. PMID 21320545.
- ^ Луховицкая Н.И., Тадури С., Гарушянц С.К., Торранс Л., Савенков Е.И. (2013). «Расшифровка механизма биогенеза дефектной интерферирующей РНК (ДИ РНК) показывает, что вирусный белок и ДИ РНК действуют антагонистически при вирусной инфекции». Дж. Вирол. 87 (11): 6091–103. Дои:10.1128 / JVI.03322-12. ЧВК 3648117. PMID 23514891.
- ^ Хуанг А.С., Балтимор Д. (1970). «Дефектные вирусные частицы и процессы вирусного заболевания». Природа. 226 (5243): 325–7. Дои:10.1038 / 226325a0. PMID 5439728.
- ^ Яворски, Э; Раус, А (май 2017 г.). «Параллельное секвенирование ClickSeq и Nanopore проливает свет на быструю эволюцию дефектно-интерферирующих РНК в вирусе Flock House». Патогены PLOS. 13 (5): e1006365. Дои:10.1371 / journal.ppat.1006365. ЧВК 5435362. PMID 28475646.
- ^ Resende Rde, O; de Haan, P; ван де Фоссен, Э; де Авила, AC; Гольдбах, Р. Петерс, Д. (октябрь 1992 г.). «Дефектные интерферирующие сегменты L РНК вируса пятнистого увядания томатов сохраняют оба конца генома вируса и имеют обширные внутренние делеции». Журнал общей вирусологии. 73 (Pt 10) (10): 2509–16. Дои:10.1099/0022-1317-73-10-2509. PMID 1402797.
- ^ Шуберт М., Лаццарини Р.А. (1981). «Структура и происхождение РНК дефектной интерферирующей частицы snapback вируса везикулярного стоматита». Дж. Вирол. 37 (2): 661–72. ЧВК 171054. PMID 6261012.
- ^ Фодор Э., Притлов, округ Колумбия, Браунли Г.Г. (1994). «Вирус гриппа участвует в инициации транскрипции». Дж. Вирол. 68 (6): 4092–6. ЧВК 236924. PMID 8189550.
- ^ Dimmock, N.J .; Истон, А. Дж. (2014). «Дефектные интерферирующие РНК вируса гриппа: пора переоценить их клинический потенциал в качестве противовирусных препаратов широкого спектра действия?». Журнал вирусологии. 88 (10): 5217–27. Дои:10.1128 / JVI.03193-13. ЧВК 4019098. PMID 24574404.
- ^ Раус, А. (2014). «Обнаружение функциональных геномных мотивов в вирусах с помощью ViReMa - Virus Recombination Mapper - для анализа данных секвенирования следующего поколения». Нуклеиновые кислоты Res. 42 (2): e11. Дои:10.1093 / nar / gkt916. ЧВК 3902915. PMID 24137010.
- ^ Боклер, Г. (2018). «DI-tector: детектор дефектных интерферирующих вирусных геномов для данных секвенирования нового поколения». РНК. 24 (10): 1285–1296. Дои:10.1261 / rna.066910.118. ЧВК 6140465. PMID 30012569.