WikiDer > Вычитание цифрового транскриптома - Википедия
Вычитание цифрового транскриптома (DTS) это биоинформатика метод обнаружения присутствия новых транскриптов патогенов путем компьютерного удаления последовательностей хозяина. DTS - это прямой in silico аналог мокрая лаборатория подход Анализ репрезентативных различий (RDA), и это стало возможным благодаря беспристрастной высокопроизводительное секвенирование и наличие высококачественного аннотированного эталонного генома хозяина. Метод специально исследует этиологический агент инфекционные заболевания и наиболее известен открытием Полимавирус клетки Меркеля, подозреваемый возбудитель в Карцинома из клеток Меркеля.[1]
История
Использование вычислительного вычитания для обнаружения новых патогенов было впервые предложено в 2002 году Мейерсоном и соавт.[2] используя человека метка выраженной последовательности (EST) наборы данных. В Доказательство принципа эксперимент, Meyerson et al. продемонстрировал, что это осуществимый подход, используя Вирус Эпштейна-Барра-инфицированные лимфоциты в посттрансплантационное лимфопролиферативное заболевание (PTLD).[3]
В 2007 году термин «вычитание цифровых транскриптомов» был введен в обращение Чанг-Мур группа,[4] и был использован для обнаружения полимавируса клеток Меркель в Карцинома из клеток Меркеля.[1]
Одновременно с открытием MCV этот подход использовался для причастности романа аренавирус как причина смерти в случае, когда три пациента умерли от аналогичных болезней вскоре после трансплантация органов от одного донора.[5]
Метод

Создание библиотеки кДНК
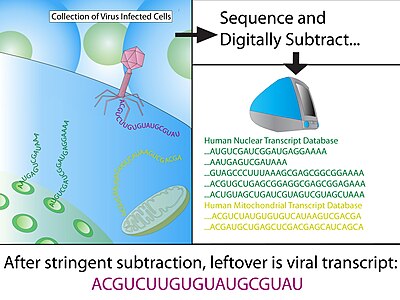
После лечения с ДНКаза I для удаления геномной ДНК человека, всего РНК извлекается из первично инфицированной ткани. Посланник РНК затем очищается с использованием колонки олиго-dT, которая связывается с поли-А хвост, сигнал, специфически обнаруживаемый на транскрибируемых генах. Используя случайную затравку гексамеров, обратная транскриптаза (RT) преобразовать всю мРНК в кДНК и клонировали в бактериальные векторы. Бактерии, обычно Кишечная палочка, затем трансформируют с использованием векторов кДНК и отбирают с помощью маркера, коллекция трансформированных клонов представляет собой библиотеку кДНК. Это генерирует мгновенный снимок мРНК ткани, которая является стабильной и может быть секвенирована на более позднем этапе.
Последовательность и контроль качества
Библиотека кДНК должна быть секвенирована на большую глубину (то есть количество секвенированных клонов), чтобы обнаружить теоретическую последовательность редкого патогена (таблица 1), особенно если чужеродная последовательность является новой. Chang-Moore рекомендует глубину секвенирования не менее 200 000 транскриптов с использованием нескольких платформ секвенирования.[1]
| % Популярный | 5000 клонов | 10000 клонов | 20000 клонов | 50 000 клонов |
|---|---|---|---|---|
| 0.001% | 4.9% | 9.5% | 18.1% | 39.3% |
| 0.01% | 39.3% | 32.2% | 86.5% | 99.3% |
| 0.02% | 63.2% | 86.5% | 98.2% | >99.995% |
| 0.03% | 77.7% | 95.5% | 99.8% | >99.995% |
| 0.04% | 86.5% | 98.2% | >99.995% | >99.995% |
| 0.1% | 99.3% | >99.995% | >99.995% | >99.995% |
Затем к необработанным последовательностям применяется строгий контроль качества для минимизации ложноположительных результатов. Экран начального качества использует несколько общих параметров, чтобы исключить неоднозначные последовательности, оставив после себя набор данных высокоточного (Hi-Fi) чтения.
- Низкий Оценка Phred cutoff используется для удаления конечных последовательностей низкого качества. Обычно пороговое значение 20 или 30 баллов Phred используется для обеспечения точности 99% -99,9% при каждом вызове базы.
- Удаление вектора и адаптера.
- Низкая сложность - оценка сложности последовательности отражает количество идентичных оснований в серии (гомополимеры), такие как поли-dT или поли-dA.
- Человек повторяющаяся ДНК.
- Длина - параметр зависит от оптимизированной длины чтения, специфичной для технология секвенирования что было использовано.
- ВЗРЫВ и исключить Кишечная палочка последовательности генома.
BLAST для размещения генома
Затем с помощью MEGABLAST считывания Hi-Fi сопоставляются с последовательностями в аннотированных базах данных, и любые положительные совпадения затем вычитаются из набора данных. Минимальная длина совпадения для положительного совпадения человеческой последовательности обычно составляет 30 последовательных идентичных оснований, что соответствует оценке BLAST 60; как правило, оставшаяся последовательность снова является BLAST с менее строгими параметрами, чтобы учесть незначительные несоответствия (1 нуклеотид из 20). Подавляющее большинство последовательностей (> 99%) следует удалить из набора данных на этом этапе.
Вычтенные последовательности обычно включают:
- Эталонный человеческий транскриптом - исключает любые известные человеческие транскрипты из наборов библиотек экспрессии.
- Контрольный геном человека - устраняет гены, которые были пропущены в процессе аннотации, и любые загрязняющие геномные последовательности во время создания библиотеки кДНК.
- Митохондриальная ДНК - митохондриальная ДНК очень распространена и полиморфна из-за высокой скорости мутаций.
- Иммуноглобулиновая область - Локусы иммуноглобулина очень полиморфны и в противном случае дали бы ложноположительный результат из-за плохого выравнивания с эталонным геномом.
- Другой позвоночное животное последовательности
- Неаннотированные последовательности
Анализ «не принимающих» кандидатов
Согласование с базами данных патогенов
После строгих циклов вычитания оставшиеся последовательности группируют в неизбыточные контиги и выравнивают с известными последовательностями патогенов с использованием параметров низкой строгости. Поскольку геномы патогенов быстро мутируют, выравнивание нуклеотидов и нуклеотидов или взрыв, обычно неинформативен, поскольку возможны мутации в определенных основаниях без изменения аминокислотного остатка из-за вырождение кодонов. Соответствие in silico транслированные белковые последовательности всех 6 открытые рамки для чтения к аминокислотной последовательности к аннотированным белкам, или Blastx, является предпочтительным методом сопоставления, поскольку он увеличивает вероятность идентификации нового патогена путем сопоставления с родственным штаммом / видом.[5] На этом этапе можно также использовать экспериментальное расширение последовательностей кандидатов, чтобы максимизировать шансы на положительное совпадение.[6]
De novo сборка
В случаях, когда сопоставление с известными патогенами неинформативно или неоднозначно, контиги последовательности-кандидата могут использоваться в качестве шаблонов для грунтовка ходьба в первично инфицированной ткани для генерации полной последовательности генома патогена.[1][5] Поскольку вирусные транскрипты представляют собой чрезвычайно редкое соотношение тканевых мРНК (10 транскриптов на 1 миллион),[1] маловероятно сгенерировать транскриптом только на основе исходных последовательностей-кандидатов из-за низкий охват.
Валидация возбудителя
После того, как предполагаемый патоген был идентифицирован в данных высокопроизводительного секвенирования, необходимо подтвердить наличие патогена у инфицированных пациентов, используя более чувствительные методы, такие как:
- ОТ-ПЦР и производные методы, включая 3'- и 5'-РАСА для подтверждения существования мРНК патогена.
- Иммуногистохимия использование антител к родственному патогену для определения наличия патогена в тканях.
- Серологические тесты для определения патоген-специфических титр антител.
- Бактериальная культура/вирусная культура, который рассматривается как Золотой стандарт в лабораторной диагностике.
Приложения
Основное применение DTS - идентификация патогенных вирусов при раке.[1][4] Его также можно использовать для идентификации вирусных патогенов при заболеваниях, не связанных с раком.[5] Будущие клинические применения могут включать использование DTS на регулярной основе у людей. DTS также может применяться к сельское хозяйство, определение патогенов, влияющих на продукцию. Вычисление вычитания уже использовалось в метагеномика изучить эту ассоциированную вирусную инфекцию IAPV с коллапс колонии в медоносные пчелы.[7]
Преимущества
- Не требует предварительных знаний о последовательности патогенов.[8]
- Может идентифицировать ранее не ассоциированные, потенциально поддающиеся лечению патогены.
- Использует уже доступные молекулярные методы и ресурсы.
Недостатки
- Определяет наличие патогена, но не устанавливает причинную связь с заболеванием.[8] Видеть Постулат Коха и Критерии Брэдфорда-Хилла.
- Должен иметь высоконадежный, полный эталонный транскриптом для изучаемого организма.[8]
- Отсутствие идентификации чужеродной последовательности не может полностью исключить патогенное инородное тело.[8]
Рекомендации
- ^ а б c d е ж Фэн Х., Шуда М., Чанг Й., Мур П.С. (январь 2008 г.). «Клональная интеграция полиомавируса в карциному из клеток Меркеля человека». Наука. 5866. 319 (5866): 1096–1100. Дои:10.1126 / science.1152586. ЧВК 2740911. PMID 18202256.
- ^ а б Вебер Дж., Шендуре Дж., Таненбаум Д.М., Чёрч Г.М., Мейерсон М. (февраль 2002 г.). «Идентификация последовательностей чужеродных генов путем фильтрации транскриптов против генома человека». Нат Жене. 2. 30 (2): 141–142. Дои:10,1038 / ng818. PMID 11788827. S2CID 21842679.
- ^ а б Сюй Й., Штанге-Томанн Н., Вебер Дж., Бо Р., Додж С., Дэвид Р. Г., Фоули К., Бехешти Дж., Харрис Н. Л., Биррен Б., Лендер Е. С., Мейерсон М. (март 2003 г.). «Открытие патогенов в тканях человека путем вычислений на основе последовательностей». Геномика. 3. 81 (3): 329–335. Дои:10.1016 / S0888-7543 (02) 00043-5. PMID 12659816.
- ^ а б Фэн Х., Тейлор Дж. Л., Бенос П. В., Ньютон Р., Уодделл К., Лукас С. Б., Чанг Й., Мур П. С. (август 2007 г.). «Вычитание человеческого транскриптома с использованием коротких тегов последовательности для поиска опухолевых вирусов при карциноме конъюнктивы». J Virol. 20. 81 (20): 11332–11340. Дои:10.1128 / JVI.00875-07. ЧВК 2045575. PMID 17686852.
- ^ а б c d Паласиос Дж., Дрюс Дж., Дю Л, Тран Т, Берч С., Бриз Т, Конлан С., Куан П.Л., Хуэй Дж., Маршалл Дж., Саймонс Дж. Ф., Эгхолм М., Пэддок К. Д., Ши В. Дж., Голдсмит К. С., Заки С. Р., Кэттон М. , Липкин В.И. (март 2008 г.). «Новый аренавирус в группе смертельных заболеваний, связанных с трансплантацией». N Engl J Med. 10. 358 (10): 991–998. CiteSeerX 10.1.1.453.2859. Дои:10.1056 / NEJMoa073785. PMID 18256387.
- ^ Чанг Й, Мур PS. «Открытие нового патогена: вычитание цифрового транскриптома». Архивировано из оригинал 25 января 2010 г.. Получено 1 марта 2012.
- ^ Кокс-Фостер Д.Л., Конлан С., Холмс Е.К., Паласиос Дж., Эванс Д.Д., Моран Н.А., Куан П.Л., Бриз Т., Хорниг М., Гейзер Д.М., Мартинсон В., ван Энгельсдорп Д., Калькштейн А.Л., Дрисдейл А., Хуэй Дж., Чжай Дж., Цуй Л., Хатчисон С.К., Саймонс Дж. Ф., Эгхолм М., Петтис Дж. С., Липкин В. И. (октябрь 2007 г.). «Метагеномное исследование микробов при разрушении колонии медоносных пчел». Наука. 5848. 318 (5848): 283–287. Дои:10.1126 / science.1146498. PMID 17823314. S2CID 14013425.
- ^ а б c d MacConaill L, Meyerson M (апрель 2008 г.). «Добавление патогенов путем вычитания генома». Нат Жене. 4. 40 (4): 380–382. Дои:10.1038 / ng0408-380. PMID 18368124.