WikiDer > Оссифицирующая прогрессирующая фибродисплазия
| Оссифицирующая прогрессирующая фибродисплазия | |
|---|---|
| Другие имена | ФОП, болезнь Стоунмана, болезнь Мюнхмейера |
 | |
| Последствия прогрессирующей оссифицирующей фибродисплазии - заболевания, при котором поврежденные мягкие ткани снова вырастают в кости. | |
| Произношение |
|
| Специальность | Медицинская генетика, ревматология |
| Обычное начало | До 10 лет |
| Дифференциальный диагноз | Фиброзная дисплазия |
| Прогноз | Средняя продолжительность жизни ≈ 40 лет (при правильном управлении) |
| Частота | 801 подтвержденный случай во всем мире (2017 г.); уровень заболеваемости оценивается в 0,5 случая на миллион человек. |
Оссифицирующая прогрессирующая фибродисплазия (FOP), также известный как Болезнь Мюнхмейера, чрезвычайно редкий заболевание соединительной ткани. Это тяжелое инвалидизирующее заболевание, которое не поддается лечению или лечению. Это единственное известное заболевание, при котором система органов переходит в другой.[2]
Прогрессирующая оссифицирующая фибродисплазия вызывается: мутация гена ACVR1. Мутация влияет на механизм восстановления организма, вызывая волокнистую ткань, в том числе мышца, сухожилия, и связки быть окостеневший, либо спонтанно, либо при повреждении в результате травмы. Во многих случаях легкие травмы могут вызвать суставы срастаться навсегда по мере образования новой кости и замены поврежденной мышечной ткани. Это новое костное образование (известное как «гетеротопическая оссификация») в конечном итоге формирует вторичный скелет и постепенно ограничивает способность пациента двигаться. Кость, образующаяся в результате этого процесса, идентична «нормальной» кости, просто в неподходящих местах. Косвенные данные свидетельствуют о том, что болезнь может вызывать деградацию суставов отдельно от характерного для него роста костей.[3]
Было показано, что хирургическое удаление лишней кости заставляет организм «восстанавливать» пораженный участок дополнительной костью. Хотя скорость роста костей может отличаться в зависимости от пациента, состояние в конечном итоге оставляет пострадавших обездвиженными, поскольку новая кость заменяет мускулатуру и срастается со скелетом.
Некоторые пациенты пытались расположить свое тело в положении, в котором они предпочли бы находиться во время обострения, чтобы улучшить качество своей жизни.
Признаки и симптомы
По неизвестным причинам дети, рожденные с ФОП, часто имеют деформации большие пальцы ног, иногда без сустава или, в других случаях, просто с заметной шишкой на малом суставе. Первое «обострение», которое приводит к образованию костной ткани FOP, обычно происходит в возрасте до 10 лет. Рост кости обычно идет от верхней части тела вниз, так же, как кости растут у плода. У ребенка с ФОП обычно развиваются дополнительные кости, начиная с шеи, затем в плечах, руках, области груди и, наконец, в ступнях.[нужна цитата]
В частности, окостенение обычно сначала наблюдается в дорсальной, осевой, краниальной и проксимальной областях тела. В дальнейшем заболевание прогрессирует в вентральной, аппендикулярной, каудальной и дистальной областях.[4] Однако это не обязательно происходит в таком порядке из-за обострений, вызванных травмами. Часто опухолевидные образования, характеризующие обострение болезни, появляются внезапно.
Рост костей, происходящий во время обострения, может привести к потере подвижности пораженных суставов, включая, если поражена челюсть / нижняя челюсть, неспособность полностью открыть рот, ограничение речи и еды. Конкретное проявление обострения этого состояния в суставах стопы и голеностопа может привести к ограничению возможности поставить ногу на землю. Рост костей также может привести к иммобилизации бедра или колена, что влияет на способность человека ходить. Образование лишней кости вокруг грудной клетки ограничивает расширение легких и диафрагмы, вызывая респираторные осложнения.[нужна цитата]
Поскольку заболевание встречается очень редко, его можно ошибочно диагностировать как рак или фиброз. Это приводит врачи заказать биопсия которые могут усугубить рост костной ткани FOP.[5] Наличие деформированных пальцев ног или больших пальцев рук у рожденных с ФОП помогает отличить это заболевание от других проблем со скелетом.[6]
При надлежащем врачебном лечении средний возраст выживания составляет 40 лет. Однако поздняя диагностика, травмы и инфекции могут снизить продолжительность жизни.[7]
Причины
FOP вызван аутосомный доминантный аллель на хромосоме 2q23-24.[8] Аллель имеет переменную выразительность, но полная пенетрантность. Большинство случаев вызвано спонтанной мутацией в гаметы; большинство людей с ФОП не могут или не хотят иметь детей. Похожая, но менее катастрофическая болезнь фиброзная дисплазия, что вызвано постзиготическая мутация.
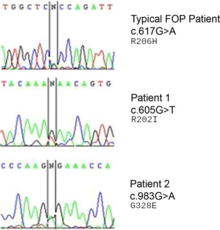
Мутация в гене ACVR1 (также известная как активин-подобная киназа 2 (ALK2)) ответственна за заболевание.[8] ACVR1 кодирует активин рецептор типа-1, а BMP рецептор типа 1. Мутация вызывает замену кодон 206 из аргинин к гистидин в белке ACVR1.[9][10] Эта замена вызывает аномальную активацию ACVR1, что приводит к трансформации соединительной ткани и мышечной ткани во вторичный скелет. Это вызывает эндотелиальные клетки преобразовать в мезенхимальные стволовые клетки а затем в кость.[11]
Генетика
ФОП - это аутосомно-доминантный беспорядок. Таким образом, ребенок пораженного гетерозиготного родителя и незатронутого родителя имеет 50% вероятность быть пораженным. Два пораженных человека могут произвести на свет здоровых детей. Два незатронутых человека могут произвести на свет пораженное потомство в результате мутации гена. Гомозиготная доминантная форма более тяжелая, чем гетерозиготная.[12]
Белок, вызывающий окостенение, обычно дезактивируется ингибирующим белком после того, как кости плода образуются в утробе матери, но у пациентов с ФОП белок продолжает работать. Аберрантное костеобразование у пациентов с ФОП происходит, когда поврежденные соединительная ткань или мышечные клетки в местах повреждения или роста неправильно экспрессируют фермент для восстановления кости во время апоптоз (саморегулируемая гибель клеток), в результате чего лимфоциты содержат избыток костный морфогенетический белок 4 (BMP4) обеспечивается во время ответа иммунной системы. Образовавшаяся кость возникает независимо от нормального скелета, образуя отдельные отдельные скелетные элементы. Однако эти элементы могут срастаться с нормальной костной тканью.[13] При этом щадятся диафрагма, язык и внеглазные мышцы, а также сердечные и гладкая мышца.[4] Поскольку неправильный фермент остается неразрешенным в иммунном ответе, организм продолжает обеспечивать неправильные BMP4-содержащие лимфоциты. BMP4 - это продукт, который способствует развитию скелета нормального эмбриона.[14]
В ACVR1 ген кодирует рецептор костного морфогенного белка (BMP); этот ген мутирован в FOP. Он отвечает за рост и развитие костей и мышц. Типичная мутация R202H делает ингибитор FKBP1A менее плотно связываются с активационной GS-петлей.[15] Конечным результатом является то, что ACVR1 не выключается эффективно, и происходит разрастание костей и хрящей и сращение суставов.[16] Аналогичным образом действуют атипичные мутации с участием других остатков. В некоторых случаях рецептор может сигнализировать о своей активности, не связываясь со своим активирующим лигандом.[17]
Большинство случаев ФОП были результатом мутации нового гена: у этих людей не было истории этого заболевания в их семье. В некоторых случаях человек унаследовал мутацию от одного больного родителя.[16]
Диагностика
Вспышки можно измерить клинически по повышенным уровням щелочная фосфатаза и костно-специфическая щелочная фосфатаза.[18] А также удаление всей костной ткани. Еще одним характерным признаком ФОП является укороченный большой палец стопы с деформированной дистальной частью первой плюсневой кости и отсутствующей или аномальной первой фалангой и / или межфаланговым суставом.[19]
Уход
Нет лекарства или одобренного лечения для ФОП.[20] Попытки хирургического удаления кости у пациента с ФОП могут привести к взрывному росту новой кости.[21] Во время прохождения анестезия, люди с ФОП могут столкнуться с трудностями с интубация, рестриктивная болезнь легких, и изменения в электрическая проводящая система сердца.[22] Следует избегать действий, повышающих риск падения или травмы мягких тканей, поскольку даже незначительная травма может спровоцировать гетеротопное образование кости.[23]
Эпидемиология
По состоянию на 2017 год во всем мире было подтверждено около 800 случаев ФОП, что сделало ФОП одним из самых редких известных заболеваний.[20] По оценкам заболеваемость заболеваемости ФОП составляет 0,5 случая на миллион человек и затрагивает все этнические группы.[20]
История
Медицинские отчеты с описанием людей, страдающих ФОП, датируются семнадцатым веком.[20] Первоначально ФОП назывался прогрессирующим оссифицирующим миозитом и считался причиной мышечного воспаления (миозит), что вызвало образование кости.[20] Болезнь была переименована Виктор А. МакКусик в 1970 году после открытия, что мягкие ткани, кроме мышц (например, связки) также пострадали от болезненного процесса.[20]
Самый известный случай FOP - случай Гарри Истлэк (1933–1973). Его состояние начало развиваться в возрасте десяти лет, и к моменту его смерти от пневмонии в ноябре 1973 года, за шесть дней до его 40-летия, его тело полностью окостенело, и он мог двигать только губами. Истлак встретил еще одного человека с ФОП в течение своей жизни.[нужна цитата]
Истлак пожертвовал свое тело науке. Его скелет сейчас на Музей Мюттера в Филадельфия, и оказался бесценным источником информации при изучении ФОП. Еще один больной ФОП, Кэрол Орзел (20 апреля 1959 г. - февраль 2018 г.) также пожертвовала свое тело музею, и ее скелет был выставлен на выставке рядом с Eastlack's в феврале 2019 года.[24] [25]
Исследование
Клинические испытания изотретиноин, этидронат с устным кортикостероиды, и пергексилин малеат не продемонстрировал эффективности, хотя вариабельность течения болезни и низкая распространенность вызывают неопределенность.[18]
Несколько фармацевтических компаний, специализирующихся на редких заболеваниях, в настоящее время находятся на разных стадиях исследования различных терапевтических подходов к ФОП.
В августе 2015 г. Управление по контролю за продуктами и лекарствами (FDA) Управление по разработке продуктов для сирот предоставило La Jolla Pharmaceuticals орфанный препарат обозначение двух новых соединений для ФОП. Соединения низкомолекулярные ингибиторы протеинкиназы предназначен для выборочной блокировки ACVR1 (ALK2).[26]
В августе 2015 г. Clementia Pharmaceuticals также начал набор детей (в возрасте от 6 лет и старше) для участия в клинических испытаниях фазы II, посвященных изучению паловаротен для лечения ФОП.[27] Доклинические исследования показали, что паловаротен, гамма-агонист рецепторов ретиноевой кислоты, блокирует аномальное образование костей в моделях на животных путем ингибирования систем вторичных мессенджеров в пути BMP.[28] Clementia получила лицензию на паловаротен от Roche Pharmaceuticals, которая ранее оценила это соединение более чем на 800 человек, включая здоровых добровольцев и пациентов с хронической обструктивной болезнью легких. Паловаротен получил обозначение Fast Track от FDA и обозначение сирот для лечения FOP от FDA и Европейское агентство по лекарствам (EMA).[27]
В сентябре 2015 г. Регенерон объявила о новом понимании механизма заболевания, связанного с активацией рецептора ACVR1 активином A. В 2016 году компания начала исследование фазы 1 своего антитела к активину, REGN 2477, на здоровых добровольцах; в 2017 году было проведено исследование фазы 2 у пациентов с ФОП.[29]
Другой потенциальный терапевтический подход включает интерференцию аллель-специфической РНК, которая нацелена на деградацию мутированной мРНК при сохранении нормальной экспрессии гена ACVR1.[30]
Дальнейшие исследования механизмов образования гетеротопической кости при ФОП могут помочь в разработке методов лечения других заболеваний, связанных с формированием внескелетной кости.
Фибро / адипогенные предшественники (FAP) могут быть типом клеток, вызывающих заболевание, ответственных за зависимое от активина A образование эктопической кости как в мышцах, так и в сухожилиях мышей, несущих FOP, вызывающую мутацию ACVR1 (R206H).[31]
По состоянию на 2019 год продолжаются клинические испытания нескольких потенциальных методов лечения.[32]
Смотрите также
- Международная ассоциация FOP
- Несовершенный остеогенез, состояние, при котором кости ломаются необычно легко из-за мутаций в генах, связанных с генами, ответственными за ФОП.
- FOP Друзья
Рекомендации
- ^ «Медицинское определение прогрессирующей оссифицирующей фибродисплазии». www.merriam-webster.com. Получено 2019-04-01.
- ^ Каплан, Фредерик С .; Шэнь, Ци; Лунев, Виталий; Земанн, Петра; Гроппе, Джей; Катагири, Такенобу; Пиньоло, Роберт Дж .; Шор, Эйлин М. (2008). «Скелетный метаморфоз при прогрессирующей оссифицирующей фибродисплазии (ФОП)». Журнал костного и минерального метаболизма. 26 (6): 521–530. Дои:10.1007 / s00774-008-0879-8. ЧВК 3620015. PMID 18979151.
- ^ Пинковски, Джен (1 марта 2019 г.). «Вот что происходит, когда ткани вашего тела превращаются в кости». Национальная география. Архивировано из оригинал 3 марта 2019 г.
- ^ а б Каплан, Фредерик С .; Ле Меррер, Мартина; Глейзер, Дэвид Л .; Пиньоло, Роберт Дж .; Голдсби, Роберт Э .; Киттерман, Джозеф А .; Гроппе, Джей; Шор, Эйлин М. (март 2008 г.). «Прогрессирующая оссифицирующая фибродисплазия». Передовая практика и исследования в клинической ревматологии. 22 (1): 191–205. Дои:10.1016 / j.berh.2007.11.007. ЧВК 2424023. PMID 18328989.
- ^ Obamuyide, HA; Огунладе, SO (март 2015 г.). «Опухоль, для которой операция принесет больше вреда, чем пользы: отчет о случае фибродисплазии Ossificans Progressiva». Нигерийский медицинский журнал для аспирантов. 22 (1): 83–8. PMID 25875418. ProQuest 1850178336.
- ^ «Прогрессирующая оссифицирующая фибродисплазия». Листер Хилл Национальный центр биомедицинских коммуникаций. Получено 2013-12-12.
- ^ Салех, Мохаммед; Командующий, Йост; Боччарди, Рената; Кинабо, Грейс; Хамель, Бен (2015). «Прогрессирующая фибродисплазия с незначительной односторонней аномалией большого пальца в спорадическом случае из Северной Танзании с распространенной мутацией ACVR1c.617G> A». Панафриканский медицинский журнал. 22: 299. Дои:10.11604 / pamj.2015.22.299.8032. ЧВК 4769042. PMID 26966495.
- ^ а б Шор, Эйлин М; Сюй, Мэйци; Фельдман, Джордж Дж; Фенстермахер, Дэвид А.; Чо, Тэ-Джун; Чой, Ин Хо; Коннор, Дж. Майкл; Делай, Патрисия; Глейзер, Дэвид Л; Лемеррер, Мартина; Морхарт, Рольф; Роджерс, Джон Джи; Смит, Роджер; Триффитт, Джеймс Т; Уртизберея, Дж. Андони; Заслофф, Михаил; Браун, Мэтью А; Каплан, Фредерик С (май 2006 г.). «Повторяющаяся мутация рецептора BMP типа I ACVR1 вызывает наследственную и спорадическую оссифицирующую прогрессирующую фибродисплазию». Природа Генетика. 38 (5): 525–527. Дои:10,1038 / ng1783. PMID 16642017. S2CID 41579747.
- ^ «Исследователи Пенна открыли ген, создающий второй скелет» (Пресс-релиз). Медицинский факультет Пенсильванского университета. 23 апреля 2006 г.
- ^ Hatsell, Сара Дж .; Идоне, Винсент; Волкен, Дана М. Алесси; Хуанг, Лили; Ким, Хён Дж .; Ван, Лили; Вэнь, Сялинь; Nannuru, Kalyan C .; Хименес, Йоханна; Се, Лицинь; Дас, Нандитха; Махоул, Женевьева; Черноморский, Ростислав; Д’Амброзио, Дэвид; Corpina, Ричард А .; Schoenherr, Christopher J .; Фили, Киран; Yu, Paul B .; Янкопулос, Джордж Д .; Мерфи, Эндрю Дж .; Экономидес, Арис Н. (2 сентября 2015 г.). «Мутация рецептора ACVR1 R206H вызывает прогрессирующую оссифицирующую фибродисплазию, придавая чувствительность к активину А». Научная трансляционная медицина. 7 (303): 303ra137. Дои:10.1126 / scitranslmed.aac4358. ЧВК 6164166. PMID 26333933.
- ^ ван Динтер, Маартен; Виссер, Нильс; де Гортер, Дэвид JJ; Дорн, Джойс; Гуманс, Мари-Жозе; де Бур, Ян; тен Дийке, Питер (23 ноября 2009 г.). «Мутация ALK2 R206H, связанная с фибродисплазией Ossificans Progressiva, придает конститутивную активность рецептору BMP типа I и сенсибилизирует мезенхимные клетки к индуцированной BMP дифференцировке остеобластов и образованию костей». Журнал исследований костей и минералов. 25 (6): 091211115834058–35. Дои:10.1359 / jbmr.091110. PMID 19929436. S2CID 207269687.
- ^ Каммингс, Майкл Р. Человеческая наследственность: принципы и проблемы Cengage Learning, 2011, [2009]. п. 77
- ^ Шор Эйлин М .; Каплан Фредерик С. (2008). «Выводы о редком генетическом заболевании образования внеклеточных костей, фибродисплазии оссификанс прогрессива (ФОП)». Кость. 43 (3): 427–443. Дои:10.1016 / j.bone.2008.05.013. ЧВК 2601573. PMID 18590993.
- ^ Кирзенбаум, Авраам (2002). Гистология и клеточная биология. Нью-Йорк: Мосби. ISBN 978-0-323-01639-1.
- ^ «AVCR1», Домашний справочник по генетике, Национальная медицинская библиотека США, август 2007 г. По состоянию на 18 февраля 2014 г.
- ^ а б «Прогрессирующая оссифицирующая фибродисплазия», Домашний справочник по генетике, Национальная медицинская библиотека США, август 2007 г. По состоянию на 18 февраля 2014 г.
- ^ Petrie, KA; Ли, WH; Bullock, AN; Pointon, JJ; Smith, R; Рассел, Р.Г.; Браун, Массачусетс; Вордсворт, ВР; Триффитт, Дж. Т. (2009). «Новые мутации в ACVR1 приводят к атипичным признакам у двух пациентов с прогрессирующей оссифицирующей фибродисплазией». PLOS ONE. 4 (3): e5005. Bibcode:2009PLoSO ... 4.5005P. Дои:10.1371 / journal.pone.0005005. ЧВК 2658887. PMID 19330033.
- ^ а б Кито, Хироши; Ачива, Масатака; Канеко, Хироши; Мисима, Кеничи; Мацусита, Масаки; Кадоно, Идзуми; Горовиц, Джон Д; Саллюсто, Бенедетта С; Оно, Кинджи; Исигуро, Наоки (2013). «Пергексилин малеат в лечении прогрессирующей оссифицирующей фибродисплазии: открытое клиническое испытание». Журнал редких заболеваний Orphanet. 8 (1): 163. Дои:10.1186/1750-1172-8-163. ЧВК 4015865. PMID 24131551.
- ^ «Фибродисплазия Ossificans Progressiva». Август 2020.
- ^ а б c d е ж Мартелли, Андерсон; Сантос, Арнальдо Родригес (3 июля 2014 г.). «Клеточные и морфологические аспекты оссифицирующей прогрессирующей фибродисплазии: уроки формирования, восстановления и биоинженерии костей». Органогенез. 10 (3): 303–311. Дои:10.4161 / org.29206. ЧВК 4750545. PMID 25482313.
- ^ Американская академия хирургов-ортопедов (май 2006 г.). «Фибродисплазия оссификанс прогрессива (ФОП)». orthoinfo.aaos.org. Архивировано из оригинал 21 июня 2012 г.. Получено 2011-10-07.
- ^ Newton, M.C .; Allen, P.W .; Райан, округ Колумбия (февраль 1990 г.). «Фибродисплазия Ossificans Progressiva». Британский журнал анестезии. 64 (2): 246–250. Дои:10.1093 / bja / 64.2.246. PMID 2317429.
- ^ «Медицинское лечение фибродисплазии Ossificans Progressiva: современные аспекты лечения» (PDF). Международная ассоциация Fibrodysplasia Ossificans Progressiva. Январь 2020.
- ^ Маккалоу, Мари (28 февраля 2019 г.). "Новая выставка в Музее Мюттера исполняет последнее желание женщины, превратившейся в кости". The Philadelphia Inquirer. Получено 28 февраля, 2019.
- ^ «Музей Мюттера показывает новый экспонат: скелет женщины из Филадельфии с редким заболеванием костей». Музей Мюттера. 5 марта 2019 г.,. Получено 7 марта, 2020.
- ^ «Фармацевтическая компания La Jolla получила статус орфанного лекарства для двух новых соединений для лечения фибродисплазии Ossificans Progressiva» (Пресс-релиз). Фармацевтическая компания La Jolla. 18 августа 2015.
- ^ а б «Clementia Pharmaceuticals расширяет текущее исследование фазы 2, чтобы включить детей с фибродисплазией оссифицирующей прогрессивной (FOP)» (Пресс-релиз). Clementia Pharmaceuticals. 25 августа 2015 г.
- ^ "Трубопровод". www.clementiapharma.com. Архивировано из оригинал 29 сентября 2015 г.. Получено 22 ноября 2015.
- ^ «Regeneron делится обновлениями своей программы текущих исследований FOP». Международная ассоциация Fibrodysplasia Ossificans Progressiva. 9 марта 2017 г.
- ^ Дж. У. Лоури; В. Розен (2012). «Аллель-специфическая интерференция РНК в FOP, подавляя ген FOP». Генная терапия. 19 (7): 701–702. Дои:10.1038 / gt.2011.190. PMID 22130446. S2CID 24990800.
- ^ Лиз-Шепард, Джон Б.; Ямамото, Масакадзу; Biswas, Arpita A .; Stoessel, Sean J .; Николас, Сара-Энн Э .; Cogswell, Кэти A .; Девараконда, Парвати М .; Шнайдер, Майкл Дж .; Cummins, Samantha M .; Лежандр, Николас П .; Ямамото, Соко; Каартинен, Веса; Хантер, Джеффри У .; Голдхэмер, Дэвид Дж. (Декабрь 2018 г.). «Активин-зависимая передача сигналов в фибро / адипогенных предшественниках вызывает прогрессирующую оссифицирующую фибродисплазию». Nature Communications. 9 (1): 471. Bibcode:2018НатКо ... 9..471л. Дои:10.1038 / s41467-018-02872-2. ЧВК 5797136. PMID 29396429.
- ^ Маккалоу, Мари (28 февраля 2019 г.). «Предстоит лечение ФОП, болезни, при которой мышцы превращаются в кости». The Philadelphia Inquirer.
дальнейшее чтение
- Коэн, М. Майкл; Хауэлл, Робин Э. (октябрь 1999 г.). «Этиология фиброзной дисплазии и синдрома МакКьюна-Олбрайта». Международный журнал оральной и челюстно-лицевой хирургии. 28 (5): 366–371. Дои:10.1016 / с0901-5027 (99) 80085-х. PMID 10535539.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |