WikiDer > Гексол - Википедия
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Трис [тетраммин-μ-дигидроксокобальт (III)] ион кобальта (III) | |
| Идентификаторы | |
3D модель (JSmol) | |
| |
| Характеристики | |
| Co4ЧАС42N12О18S3 | |
| Молярная масса | 830.31 г · моль−1 |
| Умеренно растворим в воде [1] | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
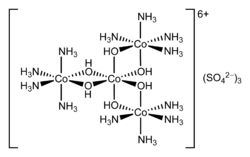
Гексол это название различных солей координационный комплекс это имеет историческое значение. Соли были первыми синтетическими неуглеродистыми хиральный соединения.[2] Сульфатная соль имеет формулу {[Co (NH3)4(ОЙ)2]3Co} (SO4)3.
Подготовка и оптическое разрешение
Соли гексола впервые были описаны Йоргенсен.[3] Соль получают нагреванием [Co (NH3)4(ЧАС2O)2]3+ с разбавленной основой, такой как аммиак с последующим осаждением сульфатной соли:
- 4 [Co (NH3)4(ЧАС2O)2]3+ → {[Co (NH3)4(ОЙ)2]3Co}6+ + 4 NH4+ + 2 часа+ + 2 часа2О
В зависимости от условий получают 9-гидрат, 6-гидрат и 4-гидрат. Эти соли существуют в виде темно-коричнево-фиолетовых или черных таблитчатых кристаллов. Соли плохо растворяются в воде. Катион может быть количественно осажден из желто-серого хромат и гексахлороплатинат соли. При обработке концентрированным соляная кислота, гексол превращается в СНГ-диакотетрамминкобальта (III) сульфат. В кипящем растворе серная кислота, гексол разлагается с выделением кислорода и азота.[1]
Оптическое разрешение
В исторической серии экспериментов Альфред Вернер полученный хиральное разрешение к фракционная кристаллизация из диастереомерный D- (+) - бромкамфорсульфонат соль. Этот ион имеет высокий удельное вращение 2640 °.[4][неудачная проверка] Более эффективные методы включают использование соли бис (тартрато) диантимоната (III).[5]
«Второй гексол»
Вернер также описал второй ахиральный гексол (незначительный побочный продукт при производстве Соль фреми), которую он неправильно определил как линейный тетрамер. Второй гексол является гексаноядерным (содержит шесть центров кобальта в каждом ионе), а не четырехъядерным.[6]
Рекомендации
- ^ а б Кауфман, Джордж Б .; Пиннелл, Роберт П. (1960). Трис [тетраммин-μ-дигидроксо-кобальт (III)] кобальт (III) сульфат 4-гидрат. Неорганические синтезы. 6. С. 176–179. Дои:10.1002 / 9780470132371.ch56. ISBN 9780470132371.
- ^ Мисслер Г. Л. и Тарр Д. А. Неорганическая химия, 3-е изд., Издательство Pearson / Prentice Hall, ISBN 0-13-035471-6.
- ^ Йоргенсен, С. М. (1898). "Zur Konstitution der Kobalt-, Chrom- und Rhodiumbasen". Zeitschrift für Anorganische Chemie. 16: 184–197. Дои:10.1002 / zaac.18980160116.
- ^ Вернер, А. (1907). "Über mehrkernige Metallammoniake" [Полиядерные металлы-амины]. Бер. Dtsch. Chem. Ges. (на немецком). 40 (2): 2103–2125. Дои:10.1002 / cber.190704002126.
- ^ Ясуи, Такадзи; Ама, Томохару; Кауфман, Джордж Б. (1992). Разрешение иона додекаамминегекса-μ-гидроксо-тетракобальта (III). Неорганические синтезы. 29. С. 169–174. Дои:10.1002 / 9780470132609.ch41. ISBN 9780470132609.
- ^ Джексон, В. Грегори; McKeon, Josephine A .; Зендер, Маргарета; Нойбергер, Маркус; Фаллаб, Сильвио (2004). «Повторное открытие второго гексола Альфреда Вернера». Химические коммуникации (20): 2322–2323. Дои:10.1039 / B408277J. PMID 15490001.
внешняя ссылка
- Hexol Molecule of the Month Сентябрь 1997 г. Интернет сайт
- Национальный реестр загрязнителей - информационный бюллетень по кобальту
