WikiDer > Мицелла
| ИЮПАК определение | |
| Мицелла | Частица коллоидных размеров, которая находится в равновесии с молекулами или ионами в растворе, из которого она образована.[1][2] |
|---|---|
| Мицеллы (полимеры) | Организованная автосборка, образованная в жидкости и состоящая из амфифильных макромолекулы, как правило, амфифильные ди- или триблок-сополимеры, состоящие из сольвофильных и сольвофобных блоков. |
| Примечание 1 | Амфифильное поведение можно наблюдать для воды и органического растворителя или между двумя органическими растворителями. |
| Заметка 2 | Полимерные мицеллы имеют гораздо более низкую критическую мицеллярную концентрацию (КМЦ), чем мицеллы мыла или поверхностно-активных веществ, но, тем не менее, находятся в равновесии с изолированными макромолекулами, называемыми унимерами. Следовательно, образование и стабильность мицелл зависят от концентрации.[3] |
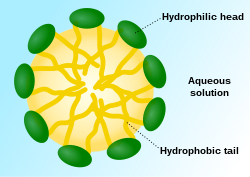
А мицелла (/маɪˈsɛл/) или же мицелла (/маɪˈsɛлə/) (множественное число мицеллы или же мицеллысоответственно) является совокупностью (или супрамолекулярная сборка) из поверхностно-активное вещество молекулы диспергированы в жидкости, образуя коллоидная суспензия. Типичная мицелла в воды образует совокупность с гидрофильный «головные» регионы, контактирующие с окружающими растворитель, секвестируя гидрофобный однохвостовые участки в центре мицеллы.
Эта фаза вызвана поведение упаковки однохвостого липиды в двухслойный. Сложность заполнения всего объема внутренней части бислоя при размещении площади на головную группу, навязанную молекуле гидратацией головной липидной группы, приводит к образованию мицеллы. Этот тип мицеллы известен как мицелла с нормальной фазой (мицелла масло в воде). Обратные мицеллы имеют головные группы в центре с выступающими хвостами (мицелла вода в масле).
Мицеллы имеют приблизительно сферическую форму. Другой фазы, включая такие формы, как эллипсоиды, цилиндры и бислои, также возможны. Форма и размер мицеллы зависят от молекулярной геометрии ее молекул поверхностно-активного вещества и условий раствора, таких как концентрация поверхностно-активного вещества, температура, pH, и ионная сила. Процесс образования мицелл известен как мицеллизация и является частью фазовое поведение многих липидов в зависимости от их полиморфизм.[4]
История
Способность мыльного раствора действовать как моющее средство признан веками. Однако только в начале двадцатого века состав таких растворов был изучен с научной точки зрения. Новаторские работы в этой области были выполнены Джеймс Уильям МакБейн на Бристольский университет. Еще в 1913 году он постулировал существование «коллоидных ионов» для объяснения хорошей электролитической проводимости пальмитат натрия решения.[5] Эти высокомобильные, спонтанно образованные кластеры стали называть мицеллами - термин, заимствованный из биологии и популяризированный Г.С.Хартли в его классической книге. Соли парафиновой цепи: исследование образования мицелл.[6] Период, термин мицелла был придуман в научной литературе девятнадцатого века как ‑Elle миниатюрный латинского слова слюда (частица), передавая новое слово для «крошечной частицы».[7]
Решение
Отдельные молекулы поверхностно-активного вещества, которые находятся в системе, но не являются частью мицеллы, называются "мономеры". Мицеллы представляют собой молекулярная сборка, в котором отдельные компоненты термодинамически находятся в равновесии с мономерами того же вида в окружающей среде. В воде гидрофильные «головы» молекул поверхностно-активного вещества всегда находятся в контакте с растворителем, независимо от того, существуют ли поверхностно-активные вещества в виде мономеров или как часть мицеллы. Однако липофильные «хвосты» молекул поверхностно-активного вещества меньше контактируют с водой, когда они являются частью мицеллы - это является основой для энергетического стимула мицеллообразования. В мицелле гидрофобные хвосты нескольких молекул поверхностно-активного вещества собираются в маслоподобное ядро, наиболее стабильная форма которого не контактирует с водой. Напротив, мономеры поверхностно-активных веществ окружены молекулами воды, которые создают «клетку» или сольватационную оболочку, соединенную между собой водородные связи. Эта водная клетка похожа на клатрат и имеет лед-подобно кристалл структура и может быть охарактеризована по гидрофобному эффекту. Степень растворимости липидов определяется неблагоприятным вкладом энтропии из-за упорядочения структуры воды в соответствии с гидрофобным эффектом.
Мицеллы, состоящие из ионных поверхностно-активных веществ, обладают электростатическим притяжением к ионам, окружающим их в растворе, последнее, известное как противоионы. Хотя ближайшие противоионы частично маскируют заряженную мицеллу (до 92%), эффекты заряда мицеллы влияют на структуру окружающего растворителя на значительных расстояниях от мицеллы. Ионные мицеллы влияют на многие свойства смеси, включая ее электропроводность. Добавление солей к мицеллам, содержащим коллоид, может снизить силу электростатических взаимодействий и привести к образованию более крупных ионных мицелл.[8] Это более точно видно с точки зрения эффективного заряда при гидратации системы.
Энергия образования
Мицеллы образуются только тогда, когда концентрация поверхностно-активного вещества больше, чем критическая концентрация мицелл (CMC), а температура системы больше критической температуры мицелл, или Крафт температура. Образование мицелл можно понять, используя термодинамика: Мицеллы могут образовывать спонтанно из-за баланса между энтропия и энтальпия. В воде гидрофобный эффект является движущей силой мицеллообразования, несмотря на то, что сборка молекул поверхностно-активного вещества невыгодна как с точки зрения энтальпии, так и энтропии системы. При очень низких концентрациях поверхностно-активного вещества в растворе присутствуют только мономеры. По мере увеличения концентрации поверхностно-активного вещества достигается точка, в которой неблагоприятный вклад энтропии от кластеризации гидрофобных хвостов молекул преодолевается увеличением энтропии из-за высвобождения сольватных оболочек вокруг хвостов поверхностно-активного вещества. На этом этапе липидные хвосты части поверхностно-активных веществ должны быть отделены от воды. Следовательно, они начинают образовывать мицеллы. В широком смысле, выше CMC, потеря энтропии из-за сборки молекул поверхностно-активного вещества меньше, чем прирост энтропии за счет высвобождения молекул воды, которые были «захвачены» сольватными оболочками мономеров поверхностно-активного вещества. Также важны энтальпийные соображения, такие как электростатические взаимодействия, которые происходят между заряженными частями поверхностно-активных веществ.
Параметр упаковки мицелл
Уравнение параметра упаковки мицелл используется для «предсказания самосборки молекул в растворах поверхностно-активных веществ»:[9]
куда объем хвоста ПАВ, длина хвоста, а - равновесная площадь на молекулу на поверхности агрегата.
Блок-сополимерные мицеллы
Понятие мицелл было введено для описания агрегатов ядро-корона малых поверхностно-активное вещество молекул, однако он также распространился на описание агрегатов амфифильный блок-сополимеры в селективных растворителях.[10][11] Важно знать разницу между этими двумя системами. Основное различие между этими двумя типами агрегатов заключается в размере их строительных блоков. Молекулы ПАВ обладают молекулярный вес который обычно составляет несколько сотен граммов на моль, тогда как блок-сополимеры обычно на один или два порядка больше. Более того, благодаря более крупным гидрофильным и гидрофобным частям блок-сополимеры могут иметь гораздо более выраженную амфифильную природу по сравнению с молекулами поверхностно-активных веществ.
Из-за этих различий в строительных блоках некоторые мицеллы блок-сополимера ведут себя как мицеллы поверхностно-активных веществ, а другие - нет. Поэтому необходимо проводить различие между этими двумя ситуациями. Первые будут принадлежать динамические мицеллы а последний будет называться кинетически замороженные мицеллы.
Динамические мицеллы
Некоторые мицеллы амфифильного блок-сополимера демонстрируют поведение, подобное мицеллам поверхностно-активного вещества. Их обычно называют динамическими мицеллами, и они характеризуются теми же релаксационными процессами, которые связаны с обменом поверхностно-активных веществ и расщеплением / рекомбинацией мицелл. Хотя релаксационные процессы между двумя типами мицелл одинаковы, кинетика унимерного обмена сильно различается. В системах с поверхностно-активными веществами унимеры уходят и присоединяются к мицеллам через распространение-управляемый процесс, для сополимеров константа скорости входа медленнее, чем процесс, управляемый диффузией. Скорость этого процесса оказалась убывающей по степенному закону степень полимеризации гидрофобного блока до мощности 2/3. Это различие связано с намоткой гидрофобного блока сополимера, выходящего из ядра мицеллы.[12]
Блок-сополимеры, которые образуют динамические мицеллы, относятся к триблоку. Полоксамеры при правильных условиях.
Кинетически замороженные мицеллы
Когда мицеллы блок-сополимера не проявляют характерных процессов релаксации мицелл поверхностно-активного вещества, они называются кинетически замороженные мицеллы. Это может быть достигнуто двумя способами: когда унимеры, образующие мицеллы, не растворимы в растворителе раствора мицелл, или если блоки, образующие ядро, являются стеклообразными при температуре, при которой находятся мицеллы. Кинетически замороженные мицеллы образуются при соблюдении любого из этих условий. Особым примером, в котором выполняются оба этих условия, является полистирол-b-поли (этиленоксид). Этот блок-сополимер характеризуется высокой гидрофобностью блока, образующего ядро, PS, что приводит к нерастворимости унимеров в воде. Кроме того, PS имеет высокий температура стеклования которая, в зависимости от молекулярной массы, выше комнатной температуры. Благодаря этим двум характеристикам водный раствор мицелл ПС-ПЭО с достаточно высокой молекулярной массой можно считать кинетически замороженным. Это означает, что никакие релаксационные процессы, которые привели бы раствор мицелл к термодинамическому равновесию, невозможны.[13] Новаторская работа с этими мицеллами была проделана Ади Айзенбергом.[14] Также было показано, как отсутствие релаксационных процессов дает большую свободу в возможных образованных морфологиях.[15][16] Более того, устойчивость к разбавлению и широкий диапазон морфологий кинетически замороженных мицелл делают их особенно интересными, например, для разработки наночастиц с длительной циркуляцией доставки лекарств.[17]
Обратные / обратные мицеллы
В неполярный растворитель, то воздействие на гидрофильные головные группы окружающего растворителя является энергетически невыгодным, что приводит к образованию системы вода-в-масле. В этом случае гидрофильные группы изолированы в ядре мицеллы, а гидрофобные группы отходят от центра. Эти обратные мицеллы пропорционально менее склонны к образованию при увеличении заряда головной группы, поскольку гидрофильная секвестрация создаст крайне неблагоприятные электростатические взаимодействия.
Супермицеллы

Супермицелла представляет собой иерархическую структуру мицелл (супрамолекулярная сборка), где отдельные компоненты также являются мицеллами. Супермицеллы образуются через вверх дном химические подходы, такие как самосборка из длинных цилиндрических мицелл на радиальные поперечные, звездообразные или одуванчик-подобные узоры в специально подобранном растворителе; твердый наночастицы могут быть добавлены к раствору, чтобы действовать как центры зародышеобразования и формировать центральное ядро супермицеллы. Стволы первичных цилиндрических мицелл состоят из различных блоков. сополимеры связаны сильными ковалентные связи; внутри структуры супермицеллы они слабо удерживаются вместе водородные связи, электростатический или сольвофобный взаимодействия.[18][19]
Использует
Когда поверхностно-активные вещества присутствуют выше критическая концентрация мицелл (CMC), они могут действовать как эмульгаторы это позволит соединению, которое обычно нерастворимо (в используемом растворителе), растворяться. Это происходит потому, что нерастворимые частицы могут быть включены в ядро мицеллы, которое само солюбилизируется в основной массе растворителя благодаря благоприятным взаимодействиям головных групп с частицами растворителя. Самый распространенный пример этого явления: моющие средства, которые очищают плохо растворимый липофильный материал (например, масла и воски), который невозможно удалить только водой. Моющие средства очищают также, опуская поверхностное натяжение воды, что облегчает удаление материала с поверхности. Эмульгирующие свойства поверхностно-активных веществ также являются основой для эмульсионная полимеризация.
Образование мицелл необходимо для усвоения жирорастворимых витаминов и сложных липидов в организме человека. Желчные соли образуются в печени и секретируются желчным пузырем, что позволяет образовывать мицеллы жирных кислот. Это обеспечивает всасывание сложных липидов (например, лецитина) и жирорастворимых витаминов (A, D, E и K) в мицелле тонкой кишкой.
В процессе свертывания молока протеазы воздействовать на растворимую часть казеины, κ-казеин, таким образом вызывая нестабильное мицеллярное состояние, которое приводит к образованию сгустка.
Мицеллы также можно использовать для адресная доставка лекарств в виде наночастиц золота.[20]
Смотрите также
- Липидный бислой
- Критическая концентрация мицелл
- Липосомы
- Мицеллярная жидкостная хроматография
- Мицеллярные растворы
- Поверхностно-активное вещество
- Пузырь (биология)
Рекомендации
| Схолия имеет тема профиль для Мицелла. |
- ^ MacNaugdoesht, Алан Д.; Уилкинсон, Эндрю Р., ред. (1997). Сборник химической терминологии: Рекомендации ИЮПАК (2-е изд.). Оксфорд: Blackwell Science. ISBN 978-0865426849.
- ^ Сломковский, Станислав; Alemán, José V .; Гилберт, Роберт Дж .; Гесс, Майкл; Хори, Казуюки; Джонс, химаншу Г .; Кубиса, Пшемыслав; Мейзель, Ингрид; Морманн, Вернер; Пенчек, Станислав; Степто, Роберт Ф. Т. (2011). «Терминология полимеров и процессов полимеризации в дисперсных системах (Рекомендации IUPAC 2011)». Чистая и прикладная химия. 83 (12): 2229–2259. Дои:10.1351 / PAC-REC-10-06-03.
- ^ Верт, Мишель; Дои, Йошихару; Хеллвич, Карл-Хайнц; Гесс, Майкл; Ходж, Филипп; Кубиса, Пшемыслав; Ринаудо, Маргарита; Шуэ, Франсуа (2012). «Терминология для биорелированных полимеров и приложений (Рекомендации IUPAC 2012 г.)». Чистая и прикладная химия. 84 (2): 377–410. Дои:10.1351 / PAC-REC-10-12-04.
- ^ И. В. Хэмли "Введение в мягкую материю" (Джон Вили, 2007)
- ^ МакБейн, J.W., Пер. Faraday Soc. 1913, 9, 99
- ^ Хартли, Г.С. (1936) Водные растворы солей парафиновых цепей, исследование образования мицелл, Hermann et Cie, Париж
- ^ «Мицеллы». Словарь Merriam-Webster. Получено 29 сентября, 2018.
- ^ Турро, Николас Дж .; Йекта, Ахмад (1978). «Люминесцентные зонды для растворов моющих средств. Простая процедура определения среднего числа агрегации мицелл». Журнал Американского химического общества. 100 (18): 5951–5952. Дои:10.1021 / ja00486a062.
- ^ Нагараджан Р. (2002). "Параметр молекулярной упаковки и самосборка поверхностно-активного вещества: упущенная роль хвоста поверхностно-активного вещества †". Langmuir. 18: 31–38. Дои:10.1021 / la010831y.
- ^ Хэмли, И. В. «Блок-сополимеры в растворе» (Wiley, 2005)
- ^ Kocak, G .; Tuncer, C .; Бютюн, В. (2016-12-20). «pH-чувствительные полимеры». Polym. Chem. 8 (1): 144–176. Дои:10.1039 / c6py01872f. ISSN 1759-9962.
- ^ Зана, Рауль; Маркес, Карлос; Джонер, Альберт (16 ноября 2006 г.). «Динамика мицелл триблок-сополимеров поли (этиленоксид) –поли (пропиленоксид) –поли (этиленоксид) в водном растворе». Достижения в области коллоидов и интерфейсной науки. Специальный выпуск в честь доктора К. Л. Миттала. 123–126: 345–351. Дои:10.1016 / j.cis.2006.05.011. PMID 16854361.
- ^ Николай, Тако; Коломбани, Оливье; Шассенье, Кристоф (2010). «Динамические полимерные мицеллы против замороженных наночастиц, образованных блок-сополимерами». Мягкая материя. 6 (14): 3111. Bibcode:2010SМат .... 6.3111N. Дои:10.1039 / b925666k.
- ^ Прескотт, Р.Дж. (1983). «Сообщения в редакцию». Журнал психосоматических исследований. 27 (4): 327–329. Дои:10.1016/0022-3999(83)90056-9.
- ^ Чжан, Л; Айзенберг, А (1995). «Множественные морфологии агрегатов« Crew-Cut »блок-сополимеров полистирол-b-поли (акриловая кислота)». Наука. 268 (5218): 1728–31. Bibcode:1995Научный ... 268.1728Z. Дои:10.1126 / science.268.5218.1728. PMID 17834990.
- ^ Чжу, Цзиньтао; Хейворд, Райан К. (1 июня 2008 г.). «Спонтанное образование мицелл амфифильных блок-сополимеров с множественной морфологией через межфазную нестабильность». Журнал Американского химического общества. 130 (23): 7496–7502. Дои:10.1021 / ja801268e. PMID 18479130.
- ^ D'Addio, Suzanne M .; Саад, Валид; Анселл, Стивен М .; Squiers, John J .; Адамсон, Дуглас Х .; Эррера-Алонсо, Маргарита; Wohl, Adam R .; Hoye, Thomas R .; Макоско, Кристофер В. (2012-08-20). «Влияние свойств блок-сополимера на защиту наноносителей от клиренса in vivo». Журнал контролируемого выпуска. 162 (1): 208–217. Дои:10.1016 / j.jconrel.2012.06.020. ЧВК 3416956. PMID 22732478.
- ^ а б Ли, Сяоюй; Гао, Ян; Ботт, Шарлотта Э .; Винник, Митчелл А .; Манеры, Ян (2015). «Нековалентный синтез супермицелл со сложной архитектурой с использованием пространственно ограниченных взаимодействий водородных связей». Nature Communications. 6: 8127. Bibcode:2015 НатКо ... 6.8127L. Дои:10.1038 / ncomms9127. ЧВК 4569713. PMID 26337527.
- ^ Гулд, Оливер E.C .; Цю, Хуйбинь; Ланн, Дэвид Дж .; Роуден, Джон; Харниман, Роберт Л .; Хадсон, Захари М .; Винник, Митчелл А .; Майлз, Мервин Дж .; Манеры, Ян (2015). «Трансформация и формирование паттерна супермицелл с использованием динамической голографической сборки». Nature Communications. 6: 10009. Bibcode:2015 НатКо ... 610009G. Дои:10.1038 / ncomms10009. ЧВК 4686664. PMID 26627644.
- ^ Чен, Си; Ань, Ингли; Чжао, Дунъюнь; Он, Чжэньпин; Чжан, Ян; Ченг, Цзин; Ши, Линьци (август 2008 г.). «Композиты Core-Shell-Corona Au-Micelle с настраиваемой смарт-гибридной оболочкой». Langmuir. 24 (15): 8198–8204. Дои:10.1021 / la800244g. PMID 18576675.