WikiDer > Озонолиз
| Озонолиз | |
|---|---|
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | озонолиз-криджи-механизм |
Озонолиз является органическая реакция где ненасыщенный облигации алкены, алкины, или азосоединения находятся расколотый с участием озон. Алкены и алкины образуют органические соединения в котором несколько углерод-углеродная связь был заменен карбонил группа[1][2][3] в то время как азосоединения образуют нитрозамины.[4] Результат реакции зависит от типа окисляемой кратной связи и отработка условия.
Озонолиз алкенов
Алкены могут окисляться озон формировать спирты, альдегиды или кетоны, или карбоновые кислоты. В обычной процедуре озон барботируют через раствор алкена в метанол при -78 ° C, пока раствор не приобретет характерный синий цвет из-за непрореагировавшего озона. Это указывает на полное потребление алкена. В качестве альтернативы, различные другие химические вещества могут использоваться в качестве индикаторов этой конечной точки путем обнаружения присутствия озона. Если озонолиз осуществляется путем пропускания через реакционную смесь потока кислорода, обогащенного озоном, газ, который выделяется, можно направить через йодистый калий решение. Когда раствор перестает поглощать озон, озон в пузырьках окисляет йодид до йод, что легко заметить по фиолетовому цвету.[5] Для более точного контроля самой реакции индикатор типа Судан Красный III может быть добавлен к реакционной смеси. Озон реагирует с этим индикатором медленнее, чем с заданной целью озонолиза. Озонолиз индикатора, который вызывает заметное изменение цвета, происходит только после того, как желаемая цель была поглощена. Если в субстрате есть два алкена, которые реагируют с озоном с разной скоростью, можно выбрать индикатор, собственная скорость окисления которого является промежуточной между ними, и, следовательно, остановить реакцию, когда прореагировал только наиболее чувствительный алкен в субстрате.[6] В противном случае присутствие непрореагировавшего озона в растворе (виден его синий цвет) или в пузырьках (посредством обнаружения йодида) указывает только на то, что все алкены прореагировали.
После завершения добавления затем добавляют реагент для превращения промежуточного озонида в карбонильное производное. Восстановительный отработка условия используются гораздо чаще, чем окислительные. Использование трифенилфосфин, тиомочевина, цинк пыль, или диметилсульфид производит альдегиды или кетоны при использовании борогидрид натрия производит спирты. Использование пероксид водорода производит карбоновые кислоты. В последнее время использование амина N-оксиды сообщалось, что непосредственно производит альдегиды.[7] Другой функциональные группы, такие как бензил эфиры, также может окисляться озоном. Было высказано предположение, что небольшие количества кислоты могут образовываться во время реакции из-за окисления растворителя, поэтому пиридин иногда используется буфер Реакция. Дихлорметан часто используется в качестве сорастворителя 1: 1 для облегчения своевременного расщепления озонида. Азелаиновая кислота и пеларгоновые кислоты производятся озонолизом олеиновая кислота в промышленных масштабах.
Примером может служить озонолиз эвгенол превращение концевого алкена в альдегид:[8]
Контролируя условия реакции / обработки, несимметричные продукты могут быть получены из симметричных алкенов:[9]
- С помощью ЦОХ; бикарбонат натрия (NaHCO3); диметилсульфид (ДМС) дает альдегид и диметил ацеталь
- С помощью уксусный ангидрид (Ac2O), триэтиламин (Et3N) дает метил сложный эфир и альдегид
- Использование ЦОХ; Ac2O, Et3N дает метиловый эфир и диметилацеталь.
Механизм реакции
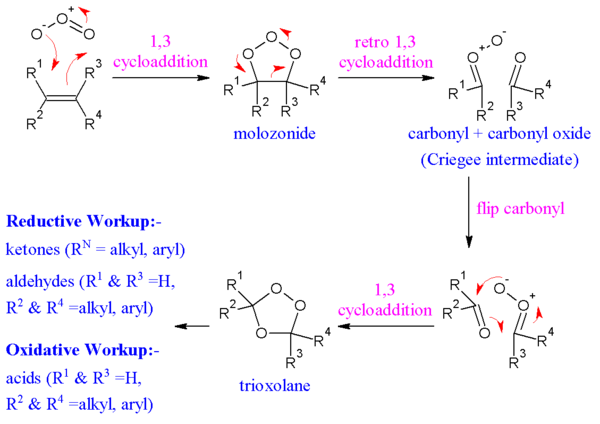
В общепринятом механизме, предложенном Рудольф Криджи в 1953 г.,[10][11][12] алкен и озон образуют промежуточное соединение молозонид в 1,3-диполярное циклоприсоединение. Затем молозонид возвращается к своему соответствующему карбонилоксид (также называемый Криджи среднего уровня или Криджи цвиттерион) и альдегид или кетон в ретро-1,3-диполярном циклоприсоединении. Оксид и альдегид или кетон снова реагируют в 1,3-диполярном циклоприсоединении или образуют относительно стабильный озонид промежуточный (а триоксолан).
Доказательства этого механизма можно найти в изотопная маркировка. Когда 17С маркировкой O бензальдегид реагирует с карбонилоксидами, метка попадает исключительно в эфирную связь озонида.[13] До сих пор ведутся споры о том, разрушается ли молозонид в результате согласованного или радикального процесса; это также может иметь зависимость от субстрата.
История
Озонолиз был изобретен Кристиан Фридрих Шёнбейн в 1840 году. До появления современных спектроскопических методов это был важный метод определения структуры органических молекул. Химики озонировали неизвестный алкен, чтобы получить более мелкие и более легко идентифицируемые фрагменты. Озонолиз алкенов иногда называют «озонолизом Харриеса», потому что некоторые приписывают эту реакцию Карл Дитрих Харрис.[14]
Озонолиз алкинов
Озонолиз алкины обычно дает ангидрид кислоты или дикетон товар,[15] не полная фрагментация по алкены. Для этих реакций восстановитель не требуется. Точный механизм полностью не известен.[16] Если реакцию проводят в присутствии воды, ангидрид гидролизуется с образованием двух карбоновые кислоты.
Озонолиз других субстратов
Озонолиз из олеиновая кислота это важный путь к азелаиновая кислота. Побочный продукт нонановая кислота:[17]
- ЧАС17C8CH = CHC7ЧАС14CO2ЧАС + 4 «О» → HO2CC7ЧАС14CO2ЧАС + ЧАС17C8CO2ЧАС
Озонолиз эластомеров
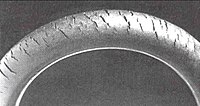
Метод был использован для подтверждения структурных повторять единицу в натуральная резина так как изопрен. Это также серьезная проблема, известная как растрескивание озона где следы газа в атмосфере вызывают деградацию эластомеры, такие как натуральная резина, полибутадиен, стирол-бутадиен и нитрильный каучук. Озонолиз создает поверхностные кетоновые группы, которые могут вызывать дальнейшее постепенное разложение через Норриш реакции если полимер подвергается воздействию света.
Растрескивание озона - это форма коррозионное растрескивание под напряжением где активные химические соединения атакуют продукты из чувствительного материала. Резиновое изделие должно находиться под напряжение для роста трещин. Растрескивание озона когда-то часто наблюдалось в боковых стенках шины, где он может расшириться и вызвать опасный задуть, но сейчас редко из-за использования современных антиозонанты. Другие средства профилактики включают замену чувствительных каучуков устойчивыми эластомерами, такими как полихлоропрен, EPDM или Витон.
Смотрите также
- Деградация полимера
- Окисление Лемье-Джонсона - альтернативная система с использованием периодата и четырехокиси осмия
- Trametes hirsuta, а биотехнологический альтернатива озонолизу.
использованная литература
- ^ Bailey, P. S .; Эриксон, Р. Э. (1973). «Дифенальдегид». Органический синтез.; Коллективный объем, 5, п. 489
- ^ Титце, Л. Ф .; Братц, М. (1998). «Диалкилмезоксалаты озонолизом диалкилбензалмалонатов». Органический синтез.; Коллективный объем, 9, п. 314
- ^ Харвуд, Лоуренс М .; Муди, Кристофер Дж. (1989). Экспериментальная органическая химия: принципы и практика (Иллюстрированный ред.). Вили-Блэквелл. стр.55–57. ISBN 978-0632020171.
- ^ Эндерс, Дитер; Киппхардт, Гельмут; Фей, Питер. «Асимметричный синтез с использованием метода SAMP- / RAMP-Hydrozone: (S) - (+) - 4-Метил-3-гептанон ». Органический синтез. 65: 183. Дои:10.15227 / orgsyn.065.0183.; Коллективный объем, 8, п. 403
- ^ Икан, Рафаэль (1991). Натуральные продукты: лабораторное руководство (2-е изд.). Сан-Диего, Калифорния: Academic Press. п. 35. ISBN 0123705517.
- ^ Вейсоглу, Тарик; Митчер, Лестер А .; Суэйзи, Джон К. (1980). «Удобный метод контроля селективной озонизации олефинов». Синтез. 1980 (10): 807–810. Дои:10.1055 / с-1980-29214.
- ^ Шварц, Крис; Raible, J .; Mott, K .; Дюссо, П. Х. (2006). «Фрагментация карбонилоксидов N-Оксиды: усовершенствованный подход к озонолизу алкенов ». Орг. Lett. 8 (15): 3199–3201. Дои:10.1021 / ol061001k. PMID 16836365.
- ^ а б Бранан, Брюс М .; Мясник, Джошуа Т .; Олсен, Лоуренс Р. (2007). «Использование озона в лаборатории органической химии: озонолиз эвгенола». J. Chem. Educ. 84 (12): 1979. Bibcode:2007JChEd..84.1979B. Дои:10.1021 / ed084p1979.
- ^ Клаус, Рональд Э .; Шрайбер, Стюарт Л. (1986). «Озонолитическое расщепление циклогексена до продуктов с конечной дифференцировкой». 64: 150. Дои:10.15227 / orgsyn.064.0150. Цитировать журнал требует
| журнал =(Помогите) - ^ Криджи Р. (1975). «Механизм озонолиза». Энгью. Chem. Int. Эд. Англ. 14 (11): 745–752. Дои:10.1002 / anie.197507451.
- ^ «Механизм озонолиза». Портал органической химии.
- ^ Ли, Джи Джек (2006). «Механизм Криджи озонолиза». Название Реакции. Springer. С. 173–174. Дои:10.1007/3-540-30031-7_77. ISBN 978-3-540-30030-4.
- ^ Гелетнеки, Ц .; Бергер, С. (1998). "Механизм озонолиза пересмотрен. 17О-ЯМР-спектроскопия ». Евро. J. Org. Chem. 1998 (8): 1625–1627. Дои:10.1002 / (SICI) 1099-0690 (199808) 1998: 8 <1625 :: AID-EJOC1625> 3.0.CO; 2-L.
- ^ Мордехай Б. Рубин (2003). «История озона, часть III, К. Д. Харрис и введение озона в органическую химию». Helv. Чим. Acta. 86 (4): 930–940. Дои:10.1002 / hlca.200390111.
- ^ Бейли, П. С. (1982). "Глава 2". Озонирование в органической химии. 2. Нью-Йорк, Нью-Йорк: Academic Press. ISBN 0-12-073102-9.
- ^ Cremer, D .; Crehuet, R .; Англада, Дж. (2001). «Озонолиз ацетилена - квантово-химическое исследование». Варенье. Chem. Soc. 123 (25): 6127–6141. Дои:10.1021 / ja010166f. PMID 11414847.
- ^ Корнилс, мальчик; Лаппе, Питер (2000). «Дикарбоновые кислоты алифатические». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a08_523. ISBN 978-3-527-30673-2.

![Озонолиз эвгенола [8]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/07/EugenolOzonolysis.png/327px-EugenolOzonolysis.png)