WikiDer > Комплекс загрузки пептидов - Википедия
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
В пептид-загрузочный комплекс (ПЛК)[1] недолговечный, мультисубъединица мембранный белок комплекс, расположенный в эндоплазматический ретикулум (ER). Он оркестрирует пептид перемещение и отбор главный комплекс гистосовместимости класса I (MHC-I) молекулы. Стабильные комплексы пептид-MHC I высвобождаются на поверхность клетки, чтобы способствовать Т-клетка ответ против злокачественных или инфицированных клеток. В свою очередь, Т-клетки распознают активированные пептиды, которые могут быть иммуногенный или неиммуногенный.
Обзор
Эта секция не цитировать любой источники. (Июль 2019) (Узнайте, как и когда удалить этот шаблон сообщения) |
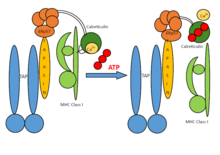
Сборка ПЛК состоит из семи субъединиц, включая транспортеры, связанные с обработка антигена (TAP1 и TAP2 - совместно именуемые TAP), оксидоредуктаза ERp57, гетеродимер MHC-I и шапероны тапасин и кальретикулин. TAP транспортирует продукты протеасомной деградации из цитозоль в просвет ЭПР, где они загружаются на молекулы MHC-I. Комплексы пептид-MHC-I затем перемещаются по секреторному пути к поверхности клетки, представляя свою антигенную нагрузку цитотоксическим Т-клеткам.
В общем, предварительные тяжелые цепи MHC-I сопровождаются системой калнексин-кальретикулин в ER. Вместе с β2-микроглобулином (β2m) тяжелые цепи MHC-I образуют сборки гетеродимеров, которые действуют как рецепторы для антигенных пептидов. Пустые гетеродимеры MHC-I рекрутируются кальретикулином и образуют короткоживущие макромолекулярные PLC, где шаперон-тапазин дополнительно обеспечивает стабилизацию в молекулах MHC-I. Кроме того, ERp57 и тапасин образуют дисульфид-связанные конъюгаты, и тапазин имеет решающее значение для поддержания структурной стабильности PLC, а также для облегчения оптимальной загрузки пептидов. После окончательного контроля качества, во время которого гетеродимеры MHC-I подвергаются редактированию пептида, стабильные комплексы пептид-MHC-I высвобождаются на поверхность клетки для распознавания Т-клетками. ПЛК может обслуживать большое количество MHC-I алломорфы, таким образом играя центральную роль в дифференцировке и праймировании Т-лимфоцитов, а также в борьбе с вирусными инфекциями и развитием опухолей.
Структура
Эта секция нужны дополнительные цитаты для проверка. (Июль 2019) (Узнайте, как и когда удалить этот шаблон сообщения) |
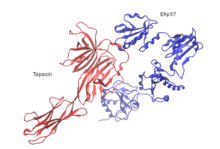
До сих пор только структура человеческого PLC была выяснена с использованием одночастичных электронная крио-микроскопия (крио-ЭМ). Структурная организация состоит из молекул тапазина, кальретикулина, ERp57 и MHC-I, которые сосредоточены вокруг TAP и имеют псевдосимметричную ориентацию. Размер PLC составляет 150 на 150 Å при общей высоте 240 Å через мембрану ER. Две противоположные молекулы тапасина формируют центральный домен в PLC. В этой модели остаток E225 N-концевого иммуноглобулиноподобного домена одной молекулы и R60, который расположен в коротком спиральном мотиве семицепочечного N-концевого β-ствола второй молекулы, на расстоянии солевой мостик . Эти остатки законсервированы у челюстных позвоночных, но отсутствуют у птиц PLC. Это согласуется с существованием единственной копии тапасина в PLC птиц и отсутствием N-концевого трансмембранного домена (TMD0) в TAP1 птиц. ER-просветные домены противоположных молекул тапасина наклонены на 30 ° друг к другу, позиционируя две точки входа в мембрану трансмембранный спирали на расстоянии 60 Å. Результирующий поворот домена исключает связывание кальретикулина или калнексин к гликан димерного тапасинового каркаса и объясняет, почему только зрелый тапасин может собираться в PLC. Другой структурной особенностью является то, что ERp57 в своей типичной U-образной конформации образует комплекс с тапазином через каталитически активные домены a и a '. Неожиданная ориентация тапазина позволяет С-концевому удлинению a 'домена транс-ERp57 взаимодействовать с С-концевым иммуноглобулин-подобным доменом цис-тапазина, потенциально повышая стабильность PLC.
Эта крио-ЭМ структура показывает высокую степень пластичности трех N-концевых β-листов сэндвича с тапасином и показывает, что гибкое крепление MHC-I необходимо для выполнения тапасином своей функции корректуры. Кальретикулин имеет решающее значение и сильно зависит от сборки и созревания MHC-I в PLC. Глобулярный лектиновый домен кальретикулина содержит сайт связывания гликана, который воспринимает моноглюкозные фрагменты N-ядра. гликозилированный MHC-I раньше ассоциировался с тапасином. Моноглюкозилированная ветвь гликана N-ядра, которая исходит от N86 MHC-I, связывается с гликан-связывающей поверхностью кальретикулина, тогда как другая ветвь маннозы, вероятно, находится рядом между остатками на краю лектинового β-сэндвича. В соответствии с его предполагаемой кальций-зависимой липид-чувствительной активностью, C-концевой кислотный хвост кальретикулина указывает на листок мембраны просвета ER, где он расположен рядом с C-концевым иммуноглобулин-подобным доменом тапазина. В структуре крио-ЭМ акцент делается на центральной роли С-концевого иммуноглобулин-подобного домена тапазина, который действует как существенное ядро поливалентного взаимодействия для остальных субъединиц PLC. Центральная полость, которая соединяет выход пути транслокации пептидов TAP с просветом ER через два боковых окна, может служить молекулярной корзиной для транспортируемых пептидов до того, как они будут редактироваться резидентными аминопептидазами ER.
КРАН
TAP представляет собой гетеродимерный комплекс, состоящий из членов TAP1 (ABCB2) и TAP2 (ABCB3) суперсемейства переносчиков ABC. Общей чертой всех переносчиков ABC является их организация: 1) в два трансмембранных домена (TMD) и 2) в два нуклеотид-связывающие домены (NBD). Оба внутримолекулярных домена связаны друг с другом и когда АТФ привязка в процессе, конформационный изменения TMD позволяют продуктам протеасомной деградации перемещаться через мембрану. TAP распознает и транспортирует антигенные пептиды, продуцируемые в цитозоле, прямо в ER, в то время как тапазин распознает те пептиды, которые обладают способностью образовывать стабильные комплексы с MHC-I. Этот процесс известен как проверка или редактирование пептидов. Пептиды, отобранные путем корректуры[2] улучшить стабильность MHC-I; тапазин также способствует редактированию иммуногенных пептидных эпитопов. Однако только недавно с помощью биохимических, биофизических и структурных исследований было доказано, что ключевой функцией адаптивного иммунитета является каталитический Механизм проверки пептидов осуществляется тапазином и TAPBPR (TAP-связывающий белок, гомолог тапазина).[3]
Тапасин
Крессвелл и его сотрудники впервые открыли тапазин (TAP-связанный гликопротеин) как белок 48 кДа в комплексах, выделенных с антителами TAP1 из лизатов дигитонина B-лимфобластоидных клеток человека.[4] Тапазин связывает HC / β2m вместе с шаперонами ER с пептидным транспортером.[5] Он расположен в ER, и его функция заключается в удерживании вместе молекул класса I вместе с шапероном кальретикулином и ERp57 для TAP. Исследования линии клеток с дефицитом тапасина и мышей, несущих нарушенный ген тапазина, короткоживущий комплекс молекул класса I.[требуется разъяснение]
Тапазин и ТАП очень важны для стабилизации молекул класса I, а также для оптимизации пептида, представленного цитотоксическим Т-клеткам.[6] PLC-независимый белок-гомолог тапазина, названный TAPBPR.[3] было обнаружено, что он обладает способностью действовать как второй специфичный для MHC-I пептидный корректор или редактор, но не обладает трансмембранным доменом.[7] Тапасин и ТАПБПР[3] совместно использовать аналогичные интерфейсы привязки на MHC-I, как показано с Рентгеновская структура TAPBPR с MHC-I (тяжелая цепь и β2-микроглобулин). Использование фоторасщепляемого высокоаффинного пептида позволило исследователям сформировать стабильные (связанные) молекулы MHC-I, а затем сформировать стабильный TAPBPR.[3] и комплекс MHC-I с расщеплением УФ-светом фотоиндуцированного пептида.
ERp57
ERp57 - это фермент тиол оксидоредуктаза семья находится в ER.[8] Он прикрепляется к субстратам косвенным образом через ассоциацию с молекулярным шапероном кальретикулином комплекса загрузки пептидов,[9][10] На ранних стадиях генерации молекул MHC-I ERp57 связан со свободными тяжелыми цепями MHC-I. В результате его функция определяется образованием дисульфидных связей в тяжелых цепях, окислительным укладыванием тяжелой цепи и, наконец, тем фактом, что ERp57 загружает пептиды на молекулы MHC-I.
MHC-I
Предварительные тяжелые цепи MHC-I образуют шапероны с помощью комплекса калнексин-кальретикулин в ER. В дополнение к этому, β2-микроглобулин (β2m) присоединяется к тяжелым цепям гетеродимеров, и в целом они действуют как рецепторы для антигенных пептидов. Когда цепи MHC-I пусты, они задействуются кальретикулином и образуют временный PLC.
Тапасин регулярно играет роль в стабилизации MHC-I. Только после того, как гетеродимеры MHC-I используются для проверки или редактирования пептидов, стабильные комплексы pMHC-I (пептид-MHC-I) высвобождаются на поверхность клетки для распознавания и уничтожения инфицированных вирусом или злокачественных опухолей. неопластический клетки. В общем, каждый отдельный организм владеет набором из шести молекул MHC-I (по три от каждого родителя). Таким образом, в аутоиммунный В экстренных случаях совместимые доноры - это родственники, которые владеют аналогичной коллекцией молекул MHC-I, помимо молекул реципиента.[нужна цитата]
Кальретикулин
Кальретикулин - особенно его лектин-подобный домен - взаимодействует с MHC-I. Домен P обращен к сайту связывания пептида MHC-I по направлению к ERp57. Эта ориентация позволяет тапасину прикрепить и закрепить MHC-I. Эта транслокация TAP облегчает его открытие в просвет ER, ограниченный стандартными точками входа мембраны, такими как точки входа тапазина и MHC-I. Эти две точки входа способствуют привлечению MHC-I с оптимальной загрузкой пептидов и, в конечном итоге, высвобождением MHC-I на поверхности Т-клеток для распознавания.[нужна цитата]
Рекомендации
- ^ Blees A, Januliene D, Hofmann T., Koller N, Schmidt C, Trowitzsch S, Moeller A, Tampé R (ноябрь 2017 г.). «Структура комплекса загрузки пептида MHC-I человека». Природа. 551 (7681): 525–528. Bibcode:2017Натура.551..525Б. Дои:10.1038 / природа24627. PMID 29107940. S2CID 4447406.
- ^ Томас С., Тампе Р. (2017). «Вычитка комплексов пептид-MHC посредством динамических поливалентных взаимодействий». Границы иммунологии. 8: 65. Дои:10.3389 / fimmu.2017.00065. ЧВК 5296336. PMID 28228754.
- ^ а б c d Томас К., Тампе Р. (ноябрь 2017 г.). «Структура комплекса TAPBPR-MHC I определяет механизм загрузки и редактирования пептида». Наука. 358 (6366): 1060–1064. Bibcode:2017Научный ... 358.1060Т. Дои:10.1126 / science.aao6001. PMID 29025996.
- ^ Ортманн Б., Андролевич М.Дж., Крессвелл П. (апрель 1994 г.). «Комплексы MHC класса I / бета 2-микроглобулин связываются с транспортерами TAP до связывания пептида». Природа. 368 (6474): 864–7. Bibcode:1994Натура.368..864O. Дои:10.1038 / 368864a0. PMID 8159247. S2CID 4268516.
- ^ Садасиван Б., Ленер П.Дж., Ортманн Б., Шпион Т., Крессвелл П. (август 1996 г.). «Роли кальретикулина и нового гликопротеина, тапазина, во взаимодействии молекул MHC класса I с TAP». Иммунитет. 5 (2): 103–14. Дои:10.1016 / S1074-7613 (00) 80487-2. PMID 8769474.
- ^ Момбург Ф., Тан П. (октябрь 2002 г.). «Тапазин - краеугольный камень загрузочного комплекса, оптимизирующего связывание пептидов молекулами MHC класса I в эндоплазматическом ретикулуме». Молекулярная иммунология. 39 (3–4): 217–33. Дои:10.1016 / S0161-5890 (02) 00103-7. PMID 12200052.
- ^ МакШан А.С., Натараджан К., Кумиров В.К., Флорес-Солис Д., Цзян Дж., Бадстюбнер М. и др. (Август 2018 г.). «Обмен пептидов на MHC-I с помощью TAPBPR обусловлен отрицательным циклом высвобождения аллостерии». Природа Химическая Биология. 14 (8): 811–820. Дои:10.1038 / s41589-018-0096-2. ЧВК 6202177. PMID 29988068.
- ^ Фрикель Е.М., Фрей П., Бувье М., Стаффорд В.Ф., Хелениус А., Глоксхубер Р., Элльгаард Л. (апрель 2004 г.). «ERp57 - многофункциональная тиолдисульфид оксидоредуктаза». Журнал биологической химии. 279 (18): 18277–87. Дои:10.1074 / jbc.M314089200. PMID 14871896.
- ^ Оливер Дж. Д., Родерик Х. Л., Ллевеллин Д. Д., High S (август 1999 г.). «ERp57 функционирует как субъединица специфических комплексов, образованных с лектинами ER кальретикулином и калнексином». Молекулярная биология клетки. 10 (8): 2573–82. Дои:10.1091 / mbc.10.8.2573. ЧВК 25489. PMID 10436013.
- ^ Чжан И, Байг Э, Уильямс ДБ (май 2006 г.). «Функции ERp57 в сворачивании и сборке основных молекул класса I комплекса гистосовместимости». Журнал биологической химии. 281 (21): 14622–31. Дои:10.1074 / jbc.M512073200. PMID 16567808.