WikiDer > Праймер димер
А димер праймера (PD) является потенциальным побочным продуктом в полимеразной цепной реакции (ПЦР), распространенный биотехнологический метод. Как следует из названия, ПД состоит из двух грунтовка молекулы, которые прикрепили (гибридизированный) друг к другу из-за строк дополнительный базы в грунтовках. В результате ДНК-полимераза амплифицирует PD, что ведет к конкуренции за реагенты для ПЦР, что потенциально препятствует амплификации ДНК последовательность, предназначенная для ПЦР-амплификации. В количественная ПЦР, PD могут мешать точной количественной оценке.
Механизм образования
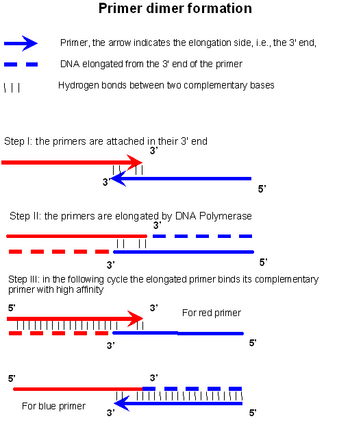
Димер праймера образуется и амплифицируется в три этапа. На первом этапе два праймера отжигаются на своих соответствующих 3 'концах (этап I на рисунке). Если эта конструкция достаточно устойчива, ДНК-полимераза будет связывать и удлинять праймеры в соответствии с комплементарной последовательностью (этап II на рисунке). Важным фактором, способствующим стабильности конструкции на этапе I, является высокий GC-контент на концах 3 'и длине нахлеста. Третий этап происходит в следующем цикле, когда одна нить продукта этапа II используется в качестве матрицы, к которой отжигаются свежие праймеры, что приводит к синтезу большего количества продукта PD.[1]
Обнаружение
Димеры праймера могут быть видны после гель-электрофорез продукта ПЦР. PD в этидиум бромид-окрашенные гели обычно видны как полоса из 30-50 пар оснований (п.о.) или мазок от умеренной до высокой интенсивности и отличимый от полосы последовательности-мишени, которая обычно длиннее 50 п.о.
В количественная ПЦР, PD могут быть обнаружены анализ кривой плавления с интеркалирующими красителями, такими как SYBR Зеленый I, неспецифический краситель для обнаружения двухцепочечной ДНК. Поскольку они обычно состоят из коротких последовательностей, PD денатурируют при более низкой температуре, чем целевая последовательность, и, следовательно, их можно отличить по характеристикам кривой плавления.
Предотвращение образования димера праймера
Один из подходов к предотвращению БП заключается в физико-химической оптимизации системы ПЦР, т.е. изменении концентраций праймеров, хлорид магния, нуклеотиды, ионная сила и температура реакции. Этот метод несколько ограничен физико-химическими характеристиками, которые также определяют эффективность амплификации целевой последовательности в ПЦР. Следовательно, уменьшение образования PD также может привести к снижению эффективности ПЦР. Чтобы преодолеть это ограничение, другие методы направлены только на уменьшение образования PD, включая дизайн праймеров и использование различных ферментных систем или реагентов ПЦР.[нужна цитата]
Программное обеспечение для грунтовки
Программное обеспечение для создания праймеров использует алгоритмы, которые проверяют потенциал ДНК. вторичная структура формирование и отжиг праймеров к себе или внутри пар праймеров. Программа учитывает следующие физические параметры: потенциальная самокомплементарность и GC-содержание праймеров; близкие температуры плавления грунтовок; и отсутствие вторичных структур, таких как стебель-петлив целевой последовательности ДНК.[2]
ПЦР с горячим стартом
Поскольку праймеры имеют низкую комплементарность друг другу, они могут отжигаться (шаг I на рисунке) только при низкой температуре, например комнатная температура, например, во время приготовления реакционной смеси. Хотя ДНК-полимеразы, используемые в ПЦР, наиболее активны при температуре около 70 ° C, они обладают некоторой полимеризационной активностью также при более низких температурах, что может вызвать синтез ДНК из праймеров после отжига друг с другом.[3] Было разработано несколько методов для предотвращения образования PD до тех пор, пока реакция не достигнет рабочей температуры (60-70 ° C), и они включают начальное ингибирование ДНК-полимеразы или физическое разделение реакции компонентов реакции до тех пор, пока реакционная смесь не достигнет более высоких температур. Эти методы называются горячий старт ПЦР.
Воск: в этом методе фермент пространственно отделен от реакционной смеси воском, который плавится, когда реакция достигает высокой температуры.[4]
Медленное высвобождение магния: ДНК-полимеразе необходимы ионы магния для активности,[5] таким образом, магний химически отделяется от реакции путем связывания с химическим соединением и выделяется в раствор только при высокой температуре. [6]
Нековалентное связывание ингибитора: в этом методе a пептид, антитело[7] или же аптамер[8] находятся нековалентно связываются с ферментом при низкой температуре и подавляют его активность. После инкубации в течение 1–5 минут при 95 ° C ингибитор высвобождается и начинается реакция.
Чувствительная к холоду полимераза Taq: представляет собой модифицированную ДНК-полимеразу, практически не проявляющую активности при низкой температуре.[9]
Химическая модификация: в этом методе малая молекула ковалентно связанный к боковая цепь из аминокислота в активный сайт ДНК-полимеразы. Небольшая молекула высвобождается из фермента путем инкубации реакционной смеси в течение 10–15 минут при 95 ° C. Как только малая молекула высвобождается, фермент активируется.[10]
Структурные модификации праймеров
Другой подход к предотвращению или уменьшению образования частичных разрядов заключается в модификации праймеров таким образом, чтобы отжиг между собой или друг с другом не приводил к удлинению.
РУКИ (ЧАСомо-тег Аssisted Nна-DИмер Sсистема[11]): нуклеотидный хвост, комплементарный 3'-концу праймера, добавляется к 5'-концу праймера. Из-за непосредственной близости 5-дюймового хвоста он отжигается с 3-дюймовым концом праймера. В результате стебель-петля праймер, который исключает отжиг с более короткими перекрытиями, но позволяет отжиг праймера до его полностью комплементарной последовательности в мишени.
Химерные праймеры: некоторые основания ДНК в праймере заменяются основаниями РНК, создавая химерная последовательность. Температура плавления химерной последовательности с другой химерной последовательностью ниже, чем у химерной последовательности с ДНК. Это различие позволяет установить такую температуру отжига, чтобы праймер отжигался со своей целевой последовательностью, но не с другими химерными праймерами.[12]
Блокированные расщепляемые праймеры: метод, известный как РНКаза H-зависимая ПЦР (рчПЦР)[13], использует термостабильную РНКазу HII для удаления блокирующей группы из праймеров ПЦР при высокой температуре. Этот фермент РНКаза HII почти не проявляет активности при низкой температуре, поэтому удаление блока происходит только при высокой температуре. Фермент также обладает присущей ему дискриминацией несоответствия праймер: матрица, что приводит к дополнительной селекции против димеров праймеров.
Предотвращение получения сигнала от димеров праймеров
Хотя описанные выше методы предназначены для уменьшения образования частичных разрядов, другой подход направлен на минимизацию сигнала, генерируемого частями разряда в количественная ПЦР. Этот подход полезен до тех пор, пока образуется мало PD и их ингибирующее действие на накопление продукта незначительно.
Четырехэтапная ПЦР: используется при работе с неспецифическими красителями, такими как SYBR Green I. Он основан на разной длине и, следовательно, разной температуре плавления PD и целевой последовательности. В этом методе сигнал получается ниже температуры плавления целевой последовательности, но выше температуры плавления PD.[14]
Зонды, специфичные для последовательности: TaqMan и молекулярный маяк зонды генерируют сигнал только в присутствии их целевой (комплементарной) последовательности, и эта повышенная специфичность предотвращает получение сигнала (но не возможные ингибирующие эффекты на накопление продукта) от PD.
Рекомендации
- ^ Альбертс; и другие. (2017). Молекулярная биология клетки (6-е изд.). Наука о гирляндах. С. 708–711.
- ^ Страница дизайна праймера Медицинского центра Лейденского университета
- ^ Патель, Юинг (2008). Полимеразная цепная реакция: методы и применение. Научная пресса. С. 595–599.
- ^ Чоу, Куин; Рассел, Мэрион; Берч, Дэвид Э .; Раймонд, Джонатан; Блох, Уилл (1992). «Предотвращение неправильного прайминга перед ПЦР и димеризации праймеров улучшает амплификации с низким числом копий». Исследования нуклеиновых кислот. 20 (7): 1717–23. Дои:10.1093 / nar / 20.7.1717. ЧВК 312262. PMID 1579465.
- ^ Ян, Линьцзин; Арора, Карунеш; Beard, William A .; Wilson, Samuel H .; Шлик, Тамар (2004). «Критическая роль ионов магния в закрытии ДНК-полимеразы бета и сборке активного сайта». Журнал Американского химического общества. 126 (27): 8441–53. Дои:10.1021 / ja049412o. PMID 15238001.
- ^ Номер заявки на патент США 2007/0254327
- ^ Номер патента США 5338671
- ^ Патент США № 6183967
- ^ Номер патента США 6214557.
- ^ Номер патента США 5677152
- ^ Брауни, Джаннин; Шоукросс, Сьюзен; Тикер, Джейн; Уиткомб, Дэвид; Ферри, Ричард; Ньютон, Клайв; Литтл, Стивен (1997). «Устранение накопления димеров праймеров в ПЦР». Исследования нуклеиновых кислот. 25 (16): 3235–41. Дои:10.1093 / nar / 25.16.3235. ЧВК 146890. PMID 9241236.
- ^ «Химерные праймеры для улучшенных реакций амплификации нуклеиновых кислот». Патентная линза.
- ^ Добосы Дж. Р., Роуз С. Д., Бельц К. Р., Рупп С. М., Пауэрс К. М., Белке М. А., Вальдер Дж. А. (август 2011 г.). «РНКаза H-зависимая ПЦР (rhPCR): улучшенная специфичность и обнаружение однонуклеотидного полиморфизма с использованием блокированных расщепляемых праймеров». BMC Biotechnology. 11: 80. Дои:10.1186/1472-6750-11-80. ЧВК 3224242. PMID 21831278.
- ^ Четырехэтапная ПЦР
внешняя ссылка
«Онлайн-программа для предсказания димеров праймеров». OligoAnalyzer 3.1. Интегрированные ДНК-технологии.
«Праймер дизайн. Что такое праймер-димер?». YouTube видео.