WikiDer > Радикальные часы
В химия, а радикальные часы это химическое соединение что помогает в косвенной методологии определить кинетика из свободнорадикальная реакция. Само соединение радикальных часов реагирует с известной скоростью, которая обеспечивает калибровку для определения скорости другой реакции.
Многие органические механизмы включают промежуточные соединения, которые нельзя идентифицировать напрямую, но которые выводятся из реакций захвата.[1] Когда такие промежуточные соединения являются радикалами, их время жизни можно определить по радикальным часам.[2][3] Альтернативный, возможно, более прямой подход включает создание и изоляцию промежуточных продуктов с помощью флэш-фотолиз и импульсный радиолиз, но такие методы трудоемки и требуют дорогостоящего оборудования. При косвенном подходе к радикальным часам можно по-прежнему получать относительные или абсолютные константы скорости без необходимости в инструментах или оборудовании, помимо тех, которые обычно необходимы для изучаемой реакции.[4]
Теория и техника
Радикальные реакции часов предполагают соревнование между мономолекулярный радикальный реакция с известным константа скорости и бимолекулярный радикальная реакция с неизвестной константой скорости с образованием нереаранжированных и перегруппированных продуктов. Перегруппировка неупорядоченного радикала U • протекает с образованием R • (часовая реакция) с известной константой скорости (kр). Эти радикалы реагируют с ловушка агент, AB, чтобы образовать неупорядоченные и перегруппированные продукты UA и RA соответственно.[5]
Выход двух продуктов можно определить по формуле газовая хроматография (GC) или ядерный магнитный резонанс (ЯМР). По концентрации улавливающего агента, известной константе скорости радикальных часов и соотношению продуктов можно косвенно установить неизвестную константу скорости.
Если химическое равновесие существует между U • и R •, перегруппированные продукты являются доминирующими.[3] Поскольку мономолекулярный реакция перегруппировки - первого порядка и бимолекулярный реакция захвата второго порядка (обе необратимые), неизвестная константа скорости (kр) можно определить по:[6]
Тактовая частота
Движущей силой радикальных часовых реакций является их способность перестраиваться.[1] Некоторые обычные радикальные часы - это радикальные циклизации, раскрытия колец и 1,2-миграции.[3] Две популярные перегруппировки - это циклизация 5-гексенила и раскрытие цикла циклопропилметила:[1]
 |  |
5-гексенильный радикал подвергается циклизации с образованием пятичленного кольца, потому что это энтропийно и энтальпийно более предпочтительна, чем возможность шестичленного кольца.[1][3] Константа скорости этой реакции составляет 2.3 × 105 s−1 при 298 К.[5]
Циклопропилметильный радикал претерпевает очень быструю перегруппировку с раскрытием цикла, которая устраняет напряжение кольца и является энтальпийно благоприятным.[1][3] Константа скорости этой реакции составляет 8,6 × 107 s−1 при 298 К.[7]
Чтобы определить абсолютные константы скорости радикальных реакций, мономолекулярные часы реакции необходимо откалибровать для каждой группы радикалов, таких как первичные алкилы в течение определенного периода времени.[3] За счет использования Спектроскопия ЭПР, абсолютные константы скорости для мономолекулярный реакции можно измерить при различных температурах.[3][4] В Уравнение Аррениуса затем можно применить для расчета константы скорости для конкретной температуры, при которой происходят радикальные часы реакции.
При использовании радикальных часов для изучения реакции существует неявное предположение, что скорость перегруппировки радикальных часов такая же, как и при определении скорости этой реакции перегруппировки. А теоретическое исследование Исследований реакций перегруппировки циклобутилметила и 5-гексенила в различных растворителях было обнаружено, что на скорость их реакции очень мало влияет природа растворителя.[5]
Скорость радикальных часов можно регулировать для увеличения или уменьшения в зависимости от того, какие типы заместителей присоединены к радикальным часам. На рисунке ниже показаны скорости радикальных часов с различными заместителями, прикрепленными к часам.[1][неудачная проверка]
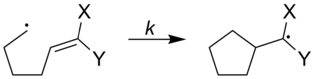 | ||
| Икс | Y | k (с−1) |
|---|---|---|
| Ph | Ph | 5x107 |
| ОСН3 | ЧАС | 1,4x105 |
| ОСН3 | CN | 2,5x108 |
| CN | ЧАС | 1,6x108 |
Выбирая среди общих классов радикальных часов и конкретных заместителей на них, можно выбрать константу скорости, подходящую для изучения реакций, имеющих широкий диапазон скоростей. Реакции со скоростью от 10−1 до 1012 M−1 s−1 были изучены с использованием радикальных часов.[2]
Примеры использования
Радикальные часы используются в снижение из алкилгалогениды с нафталинид натрия, реакция[требуется разъяснение] из Enones, то Перестановка Виттига,[8] восстановительное устранение реакции соединений диалкилртути, диоксиран дигидроксилирование, и электрофильные фторирования.[3]
Рекомендации
- ^ а б c d е ж Johnson, C.C .; Lippard, S.J .; Liu, K.E .; Ньюкомб М. (1993). "Радикальные часы-зонды подложки и исследования кинетического изотопного эффекта гидроксилирования углеводородов метанмонооксигеназой". Варенье. Chem. Soc. 115: 939–947. Дои:10.1021 / ja00056a018.CS1 maint: использует параметр авторов (связь)
- ^ а б Roschek, B. Jr .; Tallman, K.A .; Ректор, C.L .; Gillmore, J.G .; Pratt, D.A .; Пунта, С .; Портер, Н.А. (2006). "Часы с пероксильными радикалами". J. Org. Chem. 71: 3527–3532. Дои:10.1021 / jo0601462.CS1 maint: использует параметр авторов (связь)
- ^ а б c d е ж грамм час Гриллер, Д .; Ингольд, К.У. (1980). «Часы свободных радикалов». Соотв. Chem. Res. 13: 317–323. Дои:10.1021 / ar50153a004.CS1 maint: использует параметр авторов (связь)
- ^ а б Moss, R.A .; Platz, M .; Джонс, М. Реакционная промежуточная химия. Wiley, John & Sons, Incorporated, 2004. 127–128.
- ^ а б c Fu, Y .; Li, R.-Q .; Liu, L .; Го, Q.-X. (2004). «Растворитель не имеет значения для скорости радикальных часов». Res. Chem. Intermed. 30 (3): 279–286. Дои:10.1163/156856704323034012.CS1 maint: использует параметр авторов (связь)
- ^ Ньюкомб М. (1993). "Методы конкуренции и шкалы кинетики реакции алкильных радикалов". Тетраэдр. 49 (6): 1151–1176. Дои:10.1016 / S0040-4020 (01) 85808-7.CS1 maint: использует параметр авторов (связь)
- ^ Bowry, V.W .; Lusztyk, J .; Ингольд, К.У. (1991). «Калибровка нового часового механизма быстрых радикальных« часов ». Скорости раскрытия кольца для циклопропилкарбинильных радикалов, замещенных циклом и α-алкилом, и для бицикло [2.1.0] пент-2-ильного радикала». Варенье. Chem. Soc. 113: 5687–5698. Дои:10.1021 / ja00015a024.CS1 maint: использует параметр авторов (связь)
- ^ Гарст, Джон Ф .; Смит, Кальвин Д. (март 1976 г.). "Перегруппировки Виттига аралкилалкиловых эфиров". Журнал Американского химического общества. 98 (6): 1526–1537. Дои:10.1021 / ja00422a041. ISSN 0002-7863.
![{ displaystyle { begin {array} {l} { ce {U. + AB -> [k_R] {UA} + B.}} { bigg downarrow} {k_ {r}} { ce {R. + AB -> {RA} + B.}} End {array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4abb8b060be8190d61bdb4b7df1812862dca45d4)
![{ displaystyle k_ {R} = { frac {k_ {r} [{ ce {UA}}]} {{ ce {[AB] [RA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82eef2a563a3b63951d50036a74666ea862bb854)