WikiDer > SENP1
Сентрин-специфическая протеаза 1 является фермент что у людей кодируется SENP1 ген.[5][6][7]
Общее
Пока есть шесть СУМО протеазы у людей, которые были обозначены как SENP1-3 и SENP5-7 (сентрин / SUMO-специфическая протеаза) .1 Шесть протеаз обладают консервативным C-терминал доменов различного размера и с четко выраженными N-концевой домен между ними. С-концевой домен показывает каталитическая активность а N-концевой домен регулирует клеточную локализацию и субстратную специфичность.[8]
Функции
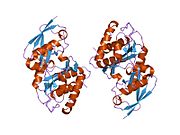
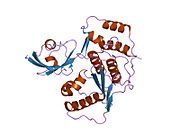
SENP1 (Sentrin-specific protease 1) представляет собой протеазу человека из 643 аминокислот с массой 73 кДа, Номер ЕС у человека 3.4.22.B70, который принимает конформацию, которая идентифицирует его как члена суперсемейства цистеиновых протеаз, содержит каталитическую триаду с охарактеризованными тремя аминокислотами: цистеин в позиции 602, а гистидин в позиции 533 и аспарагиновая кислота в положении 550. Важным нуклеофилом является цистеин, расположенный на N-конце альфа-спираль белкового ядра две другие аминокислоты, аспартат и гистидин, расположены в бета-лист конец.[9]
Расположение
Оба SENP1 расположены в ядро и цитозоль в зависимости от типа клетки, хотя было замечено, что он экспортируется из ядра в цитозоль через последовательность ядерного экспорта (NES), которая расположена на С-конце. SENP1 млекопитающих локализуется в основном в ядре.[10]
Функция
SENP1 катализирует созревание SUMO белок (небольшой модификатор, связанный с убиквитином), который вызывает гидролиз пептидной связи SUMO, находится в консервативной последовательности Gly-Gly- | -Ala-Thr-Tyr на С-конце [11] быть добавленным к конъюгации других белков (сумоилирование).[12] У позвоночных есть три члена семейства СУМО: СУМО-1, -2 и -3. SENP1 может катализировать любой из этих трех. Конъюгация SUMO с другими белками очень похожа на убиквитинирование, однако эти модификации приводят к различным результатам в зависимости от типа модифицированного белка.[13]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000079387 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000033075 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Гонг Л., Миллас С., Мол Г.Г., Йе Е.Т. (февраль 2000 г.). «Дифференциальная регуляция сенторинизированных белков с помощью новой сентин-специфической протеазы». Журнал биологической химии. 275 (5): 3355–9. Дои:10.1074 / jbc.275.5.3355. PMID 10652325.
- ^ Бейли Д., О'Хара П. (январь 2004 г.). «Характеристика локализации и протеолитической активности SUMO-специфической протеазы, SENP1». Журнал биологической химии. 279 (1): 692–703. Дои:10.1074 / jbc.M306195200. PMID 14563852.
- ^ «Ген Entrez: SENP1 SUMO1 / сентринспецифическая пептидаза 1».
- ^ Xu Z, Chau SF, Lam KH, Chan HY, Ng TB, Au SW (сентябрь 2006 г.). «Кристаллическая структура мутантного комплекса C603S-SUMO SENP1 раскрывает гидролитический механизм SUMO-специфической протеазы». Биохимический журнал. 398 (3): 345–52. Дои:10.1042 / BJ20060526. ЧВК 1559472. PMID 16712526.
- ^ Шен Л.Н., Донг С., Лю Х., Нейсмит Дж. Х., Хэй РТ (2006). «Структура комплекса SENP1-SUMO-2 предполагает структурную основу для различения паралогов SUMO во время обработки». Биохимический журнал. 397 (2): 279–288. Дои:10.1042 / BJ20052030. ЧВК 1513277. PMID 16553580.
- ^ Ким Й., Сон К.С., Ли С.Дж., Ким Ё, Чой Си, Ким И (2005). «Десумоилирование гомеодомен-взаимодействующей протеинкиназы 2 (HIPK2) посредством цитоплазматического-ядерного перемещения SUMO-специфической протеазы SENP1». Письма FEBS. 579 (27): 6272–6278. Дои:10.1016 / j.febslet.2005.10.010. PMID 16253240. S2CID 13388952.
- ^ «SENP1 - Сентринспецифическая протеаза 1 - Homo sapiens (Человек) - ген и белок SENP1».
- ^ Сюй Z, Au SW (2005). «Картирование остатков предшественников SUMO, необходимых для дифференциального созревания с помощью SUMO-специфической протеазы, SENP1». Биохимический журнал. 386 (Pt 2): 325–330. Дои:10.1042 / BJ20041210. ЧВК 1134797. PMID 15487983.
- ^ Сюй З., Чау С.Ф., Лам К.Х., Чан Х.Й., Нг ТБ, Ау ЮЗ (2006). «Кристаллическая структура мутантного комплекса C603S-SUMO SENP1 раскрывает гидролитический механизм SUMO-специфической протеазы». Биохимический журнал. 398 (3): 345–52. Дои:10.1042 / BJ20060526. ЧВК 1559472. PMID 16712526.
дальнейшее чтение
- Миколайчик Дж., Драг М., Бекеш М., Цао Дж. Т., Ронаи З., Сальвесен Г.С. (сентябрь 2007 г.). «Малый убиквитин-связанный модификатор (SUMO) -специфические протеазы: профилирование специфичности и активности человеческих SENP». Журнал биологической химии. 282 (36): 26217–24. Дои:10.1074 / jbc.M702444200. PMID 17591783.
- Drag M., Mikolajczyk J, Krishnakumar IM, Huang Z, Salvesen GS (январь 2008 г.). «Профили активности человеческих деSUMOилирующих ферментов (SENP) с синтетическими субстратами предполагает неожиданную специфичность двух недавно охарактеризованных членов семейства». Биохимический журнал. 409 (2): 461–9. Дои:10.1042 / BJ20070940. PMID 17916063. S2CID 12234952.
- Ченг Дж., Бава Т., Ли П, Гонг Л., Йе Э. Т. (август 2006 г.). «Роль десумоилирования в развитии рака простаты». Неоплазия. 8 (8): 667–76. Дои:10.1593 / neo.06445. ЧВК 1601940. PMID 16925949.
- Бейли Д., О'Хара П. (декабрь 2002 г.). «ICP0 вируса простого герпеса 1 локализуется совместно с SUMO-специфической протеазой». Журнал общей вирусологии. 83 (Pt 12): 2951–64. Дои:10.1099/0022-1317-83-12-2951. PMID 12466471.
- Cheng J, Wang D, Wang Z, Yeh ET (июль 2004 г.). «SENP1 усиливает транскрипцию, зависимую от андрогеновых рецепторов, посредством десумоилирования гистондеацетилазы 1». Молекулярная и клеточная биология. 24 (13): 6021–8. Дои:10.1128 / MCB.24.13.6021-6028.2004. ЧВК 480885. PMID 15199155.
- Xu Z, Au SW (март 2005 г.). «Картирование остатков предшественников SUMO, необходимых для дифференциального созревания с помощью SUMO-специфической протеазы, SENP1». Биохимический журнал. 386 (Pt 2): 325–30. Дои:10.1042 / BJ20041210. ЧВК 1134797. PMID 15487983.
- Boggio R, Colombo R, Hay RT, Draetta GF, Chiocca S (ноябрь 2004 г.). «Механизм ингибирования пути SUMO». Молекулярная клетка. 16 (4): 549–61. Дои:10.1016 / j.molcel.2004.11.007. PMID 15546615.
- Cheng J, Perkins ND, Yeh ET (апрель 2005 г.). «Дифференциальная регуляция c-Jun-зависимой транскрипции с помощью SUMO-специфических протеаз». Журнал биологической химии. 280 (15): 14492–8. Дои:10.1074 / jbc.M412185200. PMID 15701643.
- Раджан С., Плант Л.Д., Рабин М.Л., Батлер М.Х., Голдштейн С.А. (апрель 2005 г.). «Сумоилирование подавляет утечку через плазматическую мембрану K + канал K2P1». Ячейка. 121 (1): 37–47. Дои:10.1016 / j.cell.2005.01.019. PMID 15820677. S2CID 6314155.
- Велтман И.М., Вриде Л.А., Ченг Дж., Лойенга Л.Х., Янссен Б., Шоенмакерс Е.Ф., Йе Е.Т., ван Кессель АГ (июль 2005 г.). «Слияние гена SUMO / Sentrin-специфической протеазы 1 SENP1 и связанного с эмбриональной полярностью гена развития мезодермы MESDC2 у пациента с инфантильной тератомой и конституциональным t (12; 15) (q13; q25)». Молекулярная генетика человека. 14 (14): 1955–63. Дои:10.1093 / hmg / ddi200. PMID 15917269.
- Kim YH, Sung KS, Lee SJ, Kim YO, Choi CY, Kim Y (ноябрь 2005 г.). «Десумоилирование гомеодомен-взаимодействующей протеинкиназы 2 (HIPK2) посредством цитоплазматического-ядерного перемещения SUMO-специфической протеазы SENP1». Письма FEBS. 579 (27): 6272–8. Дои:10.1016 / j.febslet.2005.10.010. PMID 16253240. S2CID 13388952.
- Шен Л.Н., Донг С., Лю Х., Нейсмит Дж. Х., Хэй RT (июль 2006 г.). «Структура комплекса SENP1-SUMO-2 предполагает структурную основу для различения паралогов SUMO во время обработки». Биохимический журнал. 397 (2): 279–88. Дои:10.1042 / BJ20052030. ЧВК 1513277. PMID 16553580.
- Xu Z, Chau SF, Lam KH, Chan HY, Ng TB, Au SW (сентябрь 2006 г.). «Кристаллическая структура мутантного комплекса C603S-SUMO SENP1 раскрывает гидролитический механизм SUMO-специфической протеазы». Биохимический журнал. 398 (3): 345–52. Дои:10.1042 / BJ20060526. ЧВК 1559472. PMID 16712526.
- Шен Л., Татхам М.Х., Донг С., Загорска А., Нейсмит Дж. Х., Хэй RT (декабрь 2006 г.). «Протеаза SUMO SENP1 индуцирует изомеризацию ножницеобразной пептидной связи». Структурная и молекулярная биология природы. 13 (12): 1069–77. Дои:10.1038 / nsmb1172. ЧВК 3326531. PMID 17099698.