WikiDer > Одинарная облигация
Эта статья нужны дополнительные цитаты для проверка. (Август 2012 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
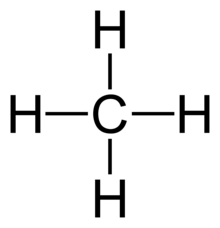
В химия, а одинарная облигация это химическая связь между двумя атомы с участием двух валентные электроны. То есть атомы разделяют одну пару электроны где образуется связь.[1] Следовательно, одинарная облигация - это разновидность Ковалентная связь. При совместном использовании каждый из двух задействованных электронов больше не находится в исключительном владении орбитальный в котором он возник. Скорее, оба электрона проводят время на любой из орбиталей, которые перекрываются в процессе связывания. Как Структура Льюисаодинарная связь обозначается как AːA или A-A, для которой A представляет собой элемент (Moore, Stanitski и Jurs 329). В первом варианте каждая точка представляет собой общий электрон, а во втором варианте полоса представляет собой оба электрона, общих в одинарной связи.
Ковалентная связь также может быть двойная связь или тройная связь. Одинарная связь слабее двойной или тройной связи. Эту разницу в силе можно объяснить, исследуя компонентные связи, из которых состоит каждый из этих типов ковалентных связей (Мур, Станицкий и Юрс, 393).
Обычно одинарная облигация - это сигма-облигация. Исключением является облигация в дибороне, который является пи бонд. Напротив, двойная связь состоит из одной сигма-связи и одной пи-связи, а тройная связь состоит из одной сигма-связи и двух пи-связей (Мур, Станицкий и Юрс 396). Количество соединений компонентов - вот что определяет несоответствие прочности. Само собой разумеется, что одинарная связь является самой слабой из трех, потому что она состоит только из сигма-связи, а двойная или тройная связь состоит не только из этого типа компонентной связи, но также по крайней мере из одной дополнительной связи.
Одинарная связь обладает способностью к вращению - свойством, которым не обладают двойная или тройная связь. Структура пи-связей не допускает вращения (по крайней мере, не при 298 К), поэтому двойная связь и тройная связь, которые содержат пи-связи, сохраняются благодаря этому свойству. Сигма-связь не столь ограничительна, и одинарная связь может вращаться, используя сигма-связь в качестве оси вращения (Мур, Станицкий и Юрс 396-397).
Другое сравнение свойств может быть выполнено по длине связи. Одинарные связи являются самыми длинными из трех типов ковалентных связей, поскольку межатомное притяжение больше в двух других типах, двойных и тройных. Увеличение количества компонентных связей является причиной увеличения притяжения по мере того, как больше электронов распределяется между связанными атомами (Мур, Станицкий и Юрс 343).
Одиночные связи часто встречаются в двухатомные молекулы. Примеры такого использования одинарных связей включают: ЧАС2, F2, и HCl.
Одинарные связи также наблюдаются в молекулах, состоящих из более чем двух атомов. Примеры такого использования одинарных связей включают:
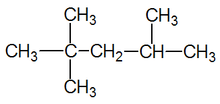
Одиночная связь проявляется даже в таких сложных молекулах, как углеводороды больше, чем метан. Тип ковалентной связи в углеводородах чрезвычайно важен в номенклатура этих молекул. Углеводороды, содержащие только одинарные связи, называются алканы (Мур, Станицкий и Юрс 334). Названия конкретных молекул, принадлежащих к этой группе, заканчиваются суффиксом -ан. Примеры включают этан, 2-метилбутан, и циклопентан (Мур, Станицкий и Юрс 335).
Рекомендации
- ^ «ковалентная связь - одинарные связи». Chemguide.co.uk. Получено 2012-08-12.
Мур, Джон У., Конрад Л. Станицки и Питер К. Юрс. Химия: молекулярная наука, Университет Индианы. Австралия: Cengage Learning, 2012. Печать.