WikiDer > Циклопентадиенид натрия
 | |||
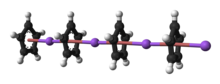 | |||
 Циклопентадиенид анион | |||
| Имена | |||
|---|---|---|---|
| Другие имена циклопентадиенилид натрия, циклопентадиенил натрий | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.023.306 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| C5ЧАС5Na | |||
| Молярная масса | 88.085 г · моль−1 | ||
| Внешность | бесцветное твердое вещество | ||
| Плотность | 1,113 г / см3 | ||
| разложение | |||
| Растворимость | THF | ||
| Опасности | |||
| Главный опасности | легковоспламеняющийся | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Циклопентадиенид натрия является натрийорганическое соединение с формула C5ЧАС5Na. Соединение часто обозначают аббревиатурой NaCp, где Cp− представляет собой анион циклопентадиенида.[1] Циклопентадиенид натрия представляет собой бесцветное твердое вещество, хотя образцы часто имеют розовый цвет из-за следов окисленных примесей.[2]
Подготовка
Циклопентадиенид натрия коммерчески доступен в виде раствора в THF. Его готовят путем обработки циклопентадиен с натрий:[3]
- 2 Na + 2 C5ЧАС6 → 2 NaC5ЧАС5 + ЧАС2
Обычно преобразование проводят путем нагревания суспензии расплавленного натрия в дициклопентадиен.[2] В прежние времена натрий обычно поставлялся в форме «натриевой проволоки» или «натриевого песка», тонкой дисперсии натрия, полученной путем плавления натрия при кипячении с обратным холодильником. ксилол и быстро помешивая.[4][5] Гидрид натрия удобная база:[6]
- NaH + C5ЧАС6 → NaC5ЧАС5 + H2
В начале работы Реактивы Гриньяра использовались как базы. С пKа из 15 циклопентадиен может быть депротонирован многими реагентами.
Приложения
Циклопентадиенид натрия является обычным реагентом для получения замещенных циклопентадиенильных солей, таких как сложноэфирные и формильные соединения NaC.5ЧАС4X (CO2Я, CHO):[7]
- NaC5ЧАС5 + HCO2R → NaC5ЧАС4CHO + ROH
Циклопентадиенид натрия - обычный реагент для приготовления металлоцены. Например, приготовление ферроцен[4] и дихлорид цирконоцена:[8]
- 2 NaC5ЧАС5 + FeCl2 → Fe (C5ЧАС5)2 + 2 NaCl
- ZrCl4(thf)2 + 2 NaCp → Cp2ZrCl2 + 2 NaCl + 2 ТГФ
Структура
Природа NaCp сильно зависит от его среды, и для целей планирования синтезов реагент часто представлен в виде соли. Na+
C
5ЧАС−
5. Кристаллический NaCp без растворителей, который встречается редко, представляет собой «полидеккер». сэндвич-комплекс, состоящую из бесконечной цепочки чередующихся Na+ центры зажаты между μ-η5:η5-C5ЧАС5 лиганды.[9] В качестве раствора в донорных растворителях NaCp сильно сольватирован, особенно в щелочном металле, что предполагает возможность выделения аддукт Na (tmeda) Ср.[10]
В отличие от циклопентадиенидов щелочных металлов, тетрабутиламмоний циклопентадиенид (Bu4N+C5ЧАС5−) было установлено, что поддерживается полностью ионной связью, и его структура представляет структуру аниона циклопентадиенида (C5ЧАС5−, Cp−) в твердом состоянии. Однако анион несколько отклоняется от плоского правильного пятиугольника с длиной связей C – C в диапазоне 138,0–140,1 пм и валентными углами C – C – C в диапазоне 107,5–108,8 °.[11]
Смотрите также
Рекомендации
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC–ИЮПАК. ISBN 0-85404-438-8. п. 262. Электронная версия.
- ^ а б Тарун К. Панда, Майкл Т. Геймер, Питер У. Роски «Улучшенный синтез циклопентадиенида натрия и калия» Металлоорганические соединения, 2003, 22, 877–878.Дои:10.1021 / om0207865
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри (1988), Продвинутая неорганическая химия (5-е изд.), Нью-Йорк: Wiley-Interscience, стр. 139, ISBN 0-471-84997-9
- ^ а б Уилкинсон, Джеффри (1963). «Ферроцен». Органический синтез.; Коллективный объем, 4, п. 473
- ^ Партридж, Джон Дж .; Chadha, Naresh K .; Ускокович, Милан Р. (1990). «Асимметричное гидроборирование 5-замещенных циклопентадиенов: синтез метилового (1р,5р) -5-гидрокси-2-циклопентен-1-ацетат ». Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 7, п. 339
- ^ Girolami, G.S .; Раухфус, Т. Б. и Анжеличи, Р. Дж. (1999). Синтез и техника в неорганической химии. Калифорния: Университетские научные книги: Милл-Вэлли. ISBN 0935702482.
- ^ Macomber, D. W .; Hart, W. P .; Рауш, М. Д. (1982). «Функционально замещенные циклопентадиенильные соединения металлов». Adv. Органомет. Chem. Успехи металлоорганической химии. 21: 1–55. Дои:10.1016 / S0065-3055 (08) 60377-9. ISBN 9780120311217.
- ^ Уилкинсон, Г.; Бирмингем, Дж. Г. (1954). «Бис-циклопентадиенильные соединения Ti, Zr, V, Nb и Ta». Варенье. Chem. Soc. 76 (17): 4281–84. Дои:10.1021 / ja01646a008.
- ^ Роберт Э. Диннебьер; Ульрих Беренс и Фальк Ольбрих (1997). «Твердотельные структуры циклопентадиениллития, -натрия и -калия. Определение методом порошковой дифракции высокого разрешения». Металлоорганические соединения. 16: 3855–3858. Дои:10.1021 / om9700122.
- ^ Эльшенбройх, К. (2006). Металлоорганические соединения. Wiley-VCH: Вайнхайм. ISBN 978-3-527-29390-2.
- ^ Reetz, Manfred T .; Хютте, Стефан; Годдард, Ричард (1995-03-01). «Тетрабутиламмониевые соли 2-нитропропана, циклопентадиена и 9-этилфлуорена: кристаллические структуры и использование в анионной полимеризации». Zeitschrift für Naturforschung B. 50 (3): 415–422. Дои:10.1515 / znb-1995-0316. ISSN 1865-7117.

