WikiDer > Тиострептон
 | |
| Имена | |
|---|---|
| Другие имена Аланинамид, Брямицин, Тиактин | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.014.304 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C72ЧАС85N19О18S5 | |
| Молярная масса | 1664,83 г / моль |
| Внешность | Порошок от белого до кремового |
| Температура плавления | От 246 до 256 ° C (от 475 до 493 ° F, от 519 до 529 K) |
| Нерастворимый | |
| Растворимость в других растворителях | Растворим в CHCl3, CH2Cl2, диоксан, пиридин, ледяная уксусная кислота, ДМФ. Практически не растворим в низших спиртах, неполярных органических растворителях, разбавленных водных кислотах или основаниях. Может быть распущен метанольный кислота или основание, но с разложением.[2] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тиострептон естественный циклический олигопептид антибиотик из тиопептид класс, производный от нескольких штаммов стрептомицеты, Такие как Streptomyces azureus и Streptomyces laurentii. Тиострептон - это натуральный продукт из синтезированный рибосомами и посттрансляционно модифицированный пептид (РиПП) класс.
История
Тиострептон был открыт Доновиком и другие. который описал его антибактериальные свойства в 1955 году.[3] Дороти Кроуфут Ходжкин решил структуру тиострептона в 1970 году.[4]В начале 1978 года Байкрофт и Гоуленд[5]предложили биосинтез тиострептона, который оставался неясным до 2009 года. Несколько исследований биосинтеза тиопептидов[6][7][8][9] были опубликованы одновременно в 2009 г., и два из них (Liao и другие. и Келли и другие.) включал аналогичный биосинтез тиострептона: он синтезируется рибосомами из генов биосинтеза тиострептона (генов tsr) и необходима посттрансляционная модификация.
Полный синтез тиострептона был завершен К.С. Николау, и другие. в 2004 г.[10][11]
Приложения
Тиострептон применялся в ветеринарии в мастит вызванный грамотрицательный организмов и при дерматологических заболеваниях. В основном используется в сложных мазях, содержащих: неомицин, нистатин, Тиострептон и актуальные стероиды. Он также активен в отношении грамположительных бактерий. Примечательно, что мази для использования человеком содержат неомицин, нистатин, и актуальные стероиды, но не тиострептон.
Сообщалось (в 2008 г.) о том, что тиострептон проявляет активность против клеток рака молочной железы, воздействуя на фактор транскрипции. коробка с вилкой M1 (FOXM1),[12] также в 2011 году.[13]Также было показано, что он предотвращает приобретенную устойчивость к цисплатину в клетках рака груди в условиях invitro.[14]
Тиострептон используется в молекулярной биологии как реагент как для положительной, так и для отрицательной селекции генов, участвующих в метаболизме нуклеотидов.
Биосинтез
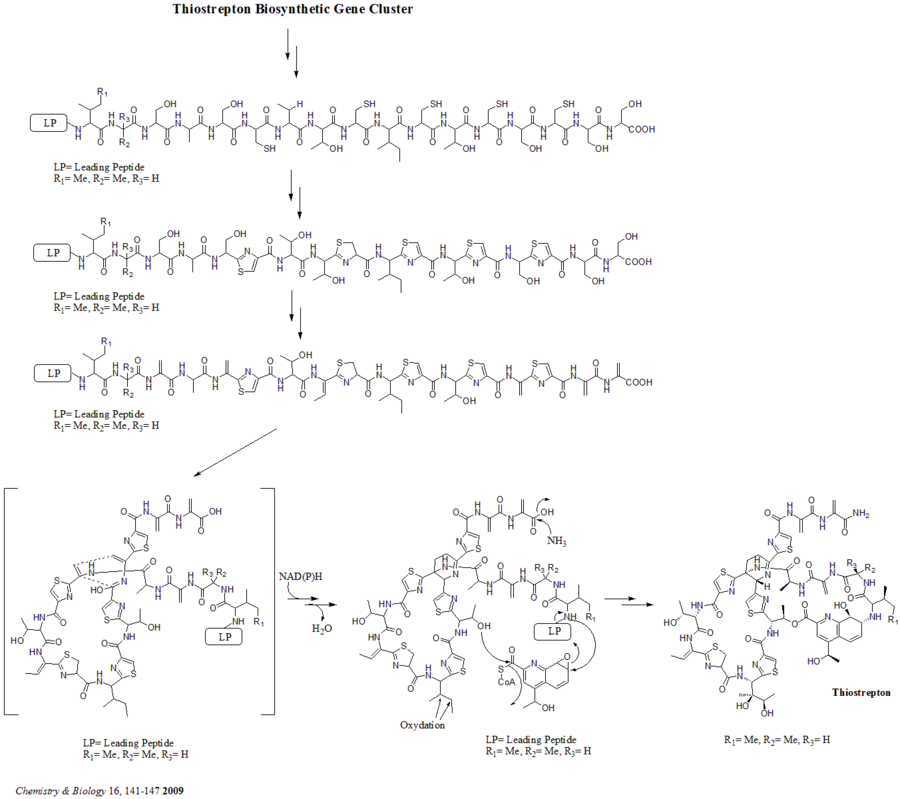
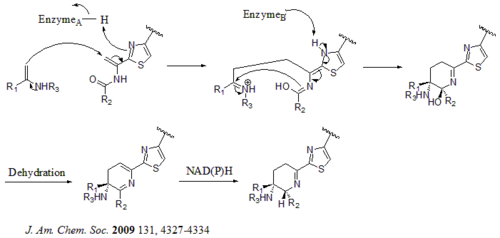
Всего в кластере биосинтетических генов 21 ген (tsrA ~ tsrU). Предшественник тиострептона содержит 58 аминокислот в пептидной цепи, которая включает 41-аминокислотный лидерный пептид (LP) и 17-аминокислотный структурный пептид (IASASCTTCICTCSCSS). После того как предшественник синтезирован, циклодегидратаза tsrO и дегидрогеназа tsrM катализируют образование тиазола или тиазолина из всех остатков цистеина в пептидной цепи. После образования тиазола / тиазолина дегидратазы tsrJ, K и S затем превращают все остатки серина в дегидроаланины. Гетеро-циклизация Дильса-Альдера центрального дегидропиперидина (в S5, C13 и S14) была предложена Байкрофтом еще в 1978 году и была использована Николау в химическом синтезе этой структуры ядра. и другие. в 2005 г. Келли также предложил альтернативный механизм образования дегидропиперидина. и другие. в 2009 г. Тем не менее, на основании экспериментальных данных предполагается, что tsrN и L ответственны за гетероциклизацию Дильса-Альдера. Предполагается, что фрагмент хинальдиновой кислоты синтезируется девятью генами tsrFAEBDUPQI из триптофана и затем приводит к закрытию макроцикла хинальдиновой кислоты. Наконец, tsrR служит кандидатом на окисление остатка Ile с образованием тиострептона.
Альтернативный механизм образования ядра дегидропиперидина
Полный синтез
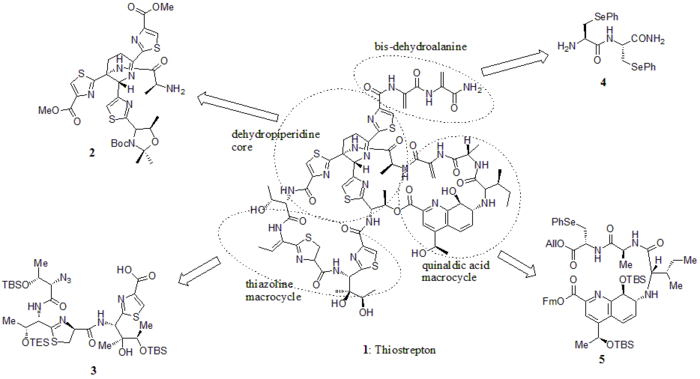
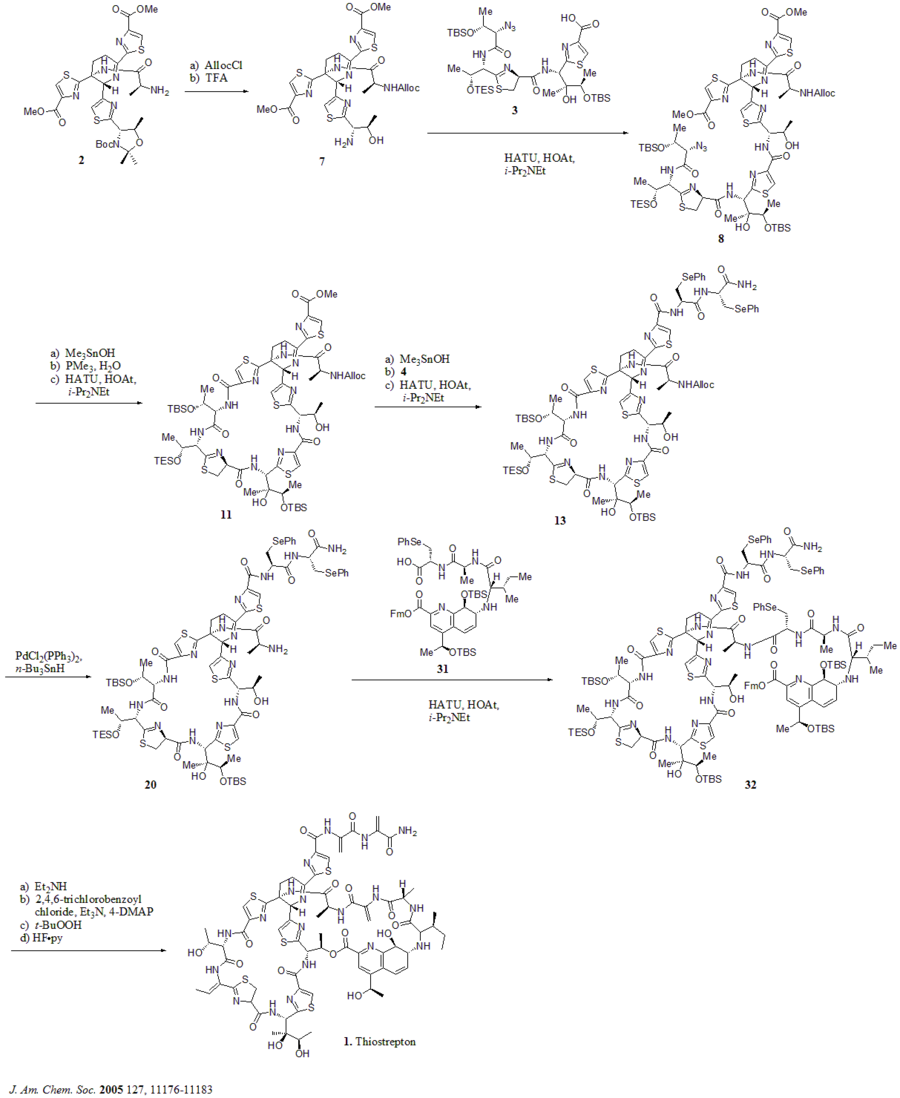
В 2005 году Николау и другие. опубликовал полный синтез тиострептона. Сначала они сконструировали ключевые строительные блоки тиострептона (1): дегидропиперидиновое ядро (2), тиазолиновый макроцикл (3), бис-дегидроаланиновый хвост (4) и макроцикл хинальдиновой кислоты (5). Затем они последовательно собрали строительные блоки, как показано на синтетической схеме (номера соединений взяты из ссылки).
Строительные блоки
Синтетическая схема
Рекомендации
- ^ Индекс Merck, 11-е издание, 9295.
- ^ Страница продукта тиострептона в Ферментек
- ^ Доновик Р., Пагано Дж. Ф., Стаут Н. А., Вайнштейн М. Дж. (1955). «Тиострептон - новый антибиотик. I. Исследования in vitro». Антибиотик Анну. 3: 554–9. PMID 13355325.
- ^ Андерсон Б., Кроуфут Ходжкин Д., Висвамитра М.А. (1970). «Структура тиострептона». Природа. 225 (5229): 223–235. Дои:10.1038 / 225233a0.
- ^ Bycroft, Barrie W .; Гоуланд, Максим С. (1978). «Структуры высокомодифицированных пептидных антибиотиков микрококцина Р1 и Р2». Журнал химического общества, химические коммуникации (6): 256. Дои:10.1039 / c39780000256. ISSN 0022-4936.
- ^ Виланд Браун LC, Акер М.Г., Кларди Дж., Уолш К.Т., Фишбах Массачусетс (2009). «Тринадцать посттрансляционных модификаций превращают пептид из 14 остатков в антибиотик тиоциллин». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 106 (8): 2549–53. Дои:10.1073 / pnas.0900008106. ЧВК 2650375. PMID 19196969.
- ^ Моррис Р.П., Лидс Дж.А., Нэгели Х.Ю., Оберер Л., Меммерт К., Вебер Э., ЛаМарш М.Дж., Паркер С.Н., Буррер Н., Эстероу С., Хайн А.Е., Шмитт Е.К., Крастел П. (2009). «Рибосомно синтезированные тиопептидные антибиотики, направленные на фактор элонгации Tu». Варенье. Chem. Soc. 131 (16): 5946–55. Дои:10.1021 / ja900488a. PMID 19338336.
- ^ Ляо Р., Дуань Л., Лей Ц., Пан Х, Дин И, Чжан Ц., Чен Д., Шен Б., Ю И, Лю В. (2009). «Биосинтез тиопептида с участием синтезированных рибосомами пептидов-предшественников и консервативных посттрансляционных модификаций». Chem. Биол. 16 (2): 141–7. Дои:10.1016 / j.chembiol.2009.01.007. ЧВК 2676563. PMID 19246004.
- ^ Келли В.Л., Пан Л., Ли К. (2009). «Биосинтез тиострептона: прототип нового семейства бактериоцинов». Варенье. Chem. Soc. 131 (12): 4327–34. Дои:10.1021 / ja807890a. PMID 19265401.
- ^ Nicolaou, K. C .; Зак, Марк; Сафина, Брайан С .; Эстрада, Энтони А .; Ли, Сан Хёп; Невалайнен, Марта (2005). «Полный синтез тиострептона. Сборка ключевых строительных блоков и завершение синтеза». Журнал Американского химического общества. 127 (31): 11176–11183. Дои:10.1021 / ja052934z. ISSN 0002-7863.
- ^ Николау К.С., Сафина Б.С., Зак М., Ли С.Х., Невалайнен М., Белла М., Эстрада А.А., Функе С., Зекри Ф.Дж., Булат С. (2005). «Полный синтез тиострептона. Ретросинтетический анализ и построение ключевых строительных блоков». Варенье. Chem. Soc. 127 (31): 11159–75. Дои:10.1021 / ja0529337. PMID 16076224.
- ^ Квок Дж. М., Мятт С. С., Марсон С. М., Кумбс Р. К., Константиниду Д., Лам Е. В. (июль 2008 г.). «Тиострептон избирательно воздействует на клетки рака молочной железы посредством ингибирования экспрессии M1 бокса вилки». Мол. Рак Ther. 7 (7): 2022–32. Дои:10.1158 / 1535-7163.MCT-08-0188. PMID 18645012.
- ^ http://www.news-medical.net/news/20110822/Scientists-reveal-how-thiostrepton-blocks-FOXM1-protein-prevents-breast-cancer-development.aspx Ученые выяснили, как тиострептон блокирует белок FOXM1, предотвращает развитие рака груди. 2011 г.
- ^ Kwok JM; Peck B; Монтейро LJ; Schwenen HD; Millour J; Coombes RC; Myatt SS; Лам EW. (Январь 2010 г.). «FOXM1 придает приобретенную устойчивость к цисплатину в клетках рака груди». Молекулярные исследования рака. 8 (1): 24–34. Дои:10.1158 / 1541-7786.MCR-09-0432. ЧВК 2809047. PMID 20068070.