WikiDer > Трицин
 | |
| Имена | |
|---|---|
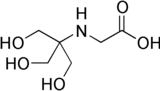
| Название ИЮПАК N- (2-гидрокси-1,1-бис (гидроксиметил) этил) глицин | |
| Другие имена Трицин N- (Три (гидроксиметил) метил) глицин | |
| Идентификаторы | |
3D модель (JSmol) | |
| 1937804 | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.024.721 |
| Номер ЕС |
|
| 3688 | |
| MeSH | трицин |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C6ЧАС13NО5 | |
| Молярная масса | 179.172 г · моль−1 |
| Внешность | Белые кристаллы |
| 89,6 г л−1 (при 20 ° C) | |
| УФ-видимый (λМаксимум) | 260 нм |
| Абсорбция | 0.03 |
| Родственные соединения | |
Родственные соединения | Миласемид |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Трицин является органическое соединение что используется в буферные растворы. Название трицин происходит от трис и глицин, из которого он был получен.[1] Это белый кристаллический порошок, умеренно растворимый в воде. Это цвиттерионный аминокислота который имеет значение pKa1 2,3 при 25 ° C, а его pKa2 при 20 ° C составляет 8,15. Его полезный буферный диапазон pH составляет 7,4-8,8. Вместе с бицина, это один из Буферные агенты Гуда. Хороший первый приготовленный трицин для буферизации хлоропластных реакций.
Приложения
Трицин обычно используется электрофорез буфер, а также используется для ресуспендирования осадка клеток. Он имеет более высокий отрицательный (более отрицательный) заряд, чем глицин позволяя ему мигрировать быстрее. Кроме того, его высокая ионная сила вызывает больше ион движение и меньше белок движение. Это позволяет снизить молекулярный вес белки должны быть разделены на меньший процент акриламидные гели. Было документально подтверждено, что трицин разделяет белки в диапазоне от 1 до 100. кДа электрофорезом.[2] Трициновый буфер в концентрации 25 ммоль / л оказался наиболее эффективным из десяти, протестированных на АТФ анализы с использованием люцифераза светлячков.[3] Трицин также оказался эффективным поглотителем гидроксильных радикалов при исследовании радиационно-индуцированного повреждения мембраны.[4]
Смотрите также
Рекомендации
- ^ Good, N.E., et al., Biochemistry, v. 5, 467 (1966).
- ^ Шеггер, Х., и фон Ягов, Г., "Электрофорез в трицин-натрий-додецилсульфат-полиакриламидном геле для разделения белков в диапазоне от 1 до 100 кДа". «Анал. Биохимия». 166 (2), 368-379.
- ^ Вебстер, Дж. Дж. И Лич, Ф. Р. "Оптимизация анализа люциферазы светлячков на АТФ". "J. Appl. Biochem.", 2: 469-479.
- ^ Хикс, М., и Гебики, Дж. М., «Константы скорости реакции гидроксильных радикалов с буферами Tris, Tricine и Hepes». "FEBS Lett.", 199 (1): 92-94.