WikiDer > Тримерный автотранспортер адгезин
В молекулярная биология, адгезины тримерного автотранспорта (TAA), белки, обнаруженные на внешняя мембрана из Грамотрицательный бактерии. Бактерии используют ТАА для заражения своих хозяин клетки через процесс, называемый клеточная адгезия.[1] TAA также имеют другое название, олигомерный спиральная катушка адгезины, сокращенно OCA. По сути, они факторы вирулентности, факторы, которые делают бактерии вредными и заразными для хозяина организм.[2]
TAA - это лишь один из многих методов, которые бактерии используют для заражения своих хозяев, инфекция приводит к таким заболеваниям, как пневмония, сепсис, и менингит. Большинство бактерий заражают своего хозяина методом, названным секреция путь. TAA являются частью секреция путь, а точнее система секреции типа Vc.[3]
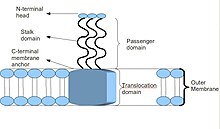
Тримерные адгезины-транспортеры имеют уникальную структуру. Структура, которую они держат, имеет решающее значение для их функции. Кажется, что все они имеют структуру «голова-стебель-якорь». Каждый TAA состоит из трех идентичных белков, отсюда и название тример. После того, как мембранный якорь вставлен во внешнюю мембрану, домен-пассажир проходит через него во внеклеточную среду хозяина автономно, отсюда и описание автотранспортера. После сборки главный домен прикрепляется к элементу хоста. внеклеточный матрикс, Например, коллаген, фибронектин, так далее.[2]
Молекулярная структура
Большинство TAA имеют аналогичную структуру белка. При наблюдении с электронная микроскопия, структура была описана как форма "леденец", состоящая из N-концевой головной домен, стеблевой домен и C-терминал мембранный анкерный домен.[2] Часто в литературе они упоминаются как Пассажирский домен, содержащую N-конец, голову, шею и спиральная катушка стебель, и Домен транслокации, имея в виду С-концевой мембранный якорь. Хотя все TAA имеют общий мембранный якорь, не все они могут содержать и стебель, и головку. Кроме того, все якорные домены мембраны имеют левостороннюю параллельную бета-ролл тип.[4]

Расположение белковых доменов тримерного автотранспорта адгезина, BadA[1] На этом рисунке показаны домены головы, стебля и якоря. На нем серым цветом изображена голова в форме Яда. Стебель содержит повторы, окрашенные в зеленый цвет, а якорь мембраны - в красный. Приведенная ниже последовательность показывает окраску в соответствии с расположением домена и сайтами расщепления протеазой красным (трипсин) и синим (химотрипсин). (Рисунок взят из журнала открытого доступа, в открытом доступе, Public Library of Science (PLoS) Pathogen
Домен расширенной сигнальной пептидной области
| ESPR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | ESPR | ||||||||
| Pfam | PF13018 | ||||||||
| |||||||||
Расширенная область сигнального пептида (ESPR) находится на N-конце сигнальных пептидов белков, принадлежащих к Системы секреции типа V. Функция ESPR - способствовать перемещению внутренней мембраны.[5] действуя как временная привязь. Это предотвращает накопление неправильно свернутых белков.[6] ESPR можно разделить на отдельные регионы, они следующие: N1 (заряжен), H1 (гидрофобный), N2, H2 и C (расщепление site) домены. N1 и H1 образуют ESPR и имеют сильную сохранение.[7]
Функция: Считается, что область расширенного сигнального пептида выполняет несколько ролей. Во-первых, биогенез белков в системе секреции V типа (T5SS). Во-вторых, считается, что белок нацеливается на внутреннюю мембрану для транслокации либо посредством пути распознавания сигнала частицы (SRP), либо посредством двойникового пути. аргинин транслоцированный (ТАТ). В-третьих, наблюдали и полагали, что он регулирует скорость миграции белка в периплазма.[7]
N-концевой головной домен
Структура: Этот конкретный домен представляет собой тример одноцепочечных левых бета-спиралей. Они объединяются, чтобы сформировать левосторонний бета-валок с девятью спиралями.[8] Он содержит мотивы последовательностей, которые сильно похожи на другие головки TAA. Это указывает на то, что при сравнении структуры белков есть много общего. Домен головы соединен со стеблем короткой, высококонсервативной последовательностью, которую часто называют шейкой или иногда коннектором.[2]
Функция: Функция этого белкового домена - связываться с внеклеточный матрикс хозяина, особенно фибронектин, коллаген, и ламинин.[9] Головной домен очень важен для прикрепления к клетке-хозяину и для аутоагглютинация, прилипая к себе.[1]
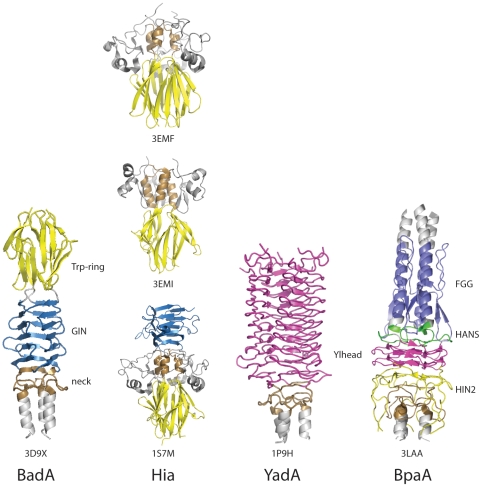
Сравнение головных доменов в различных тримерных адгезинах-транспортерах[10] (Рисунок взят из журнала открытого доступа, находящегося в открытом доступе, Патоген Публичной научной библиотеки (PLoS))
Есть несколько типов головного домена.[11] Каждый домен помогает голове связываться с разными компонентами внеклеточного матрикса. Это следующие: YadA-подобный головной домен, Trp-кольцо, GIN, FxG, HIN1 и HIN2. Эта статья посвящена первым трем упомянутым.
Яда-подобная голова
Яда-подобная голова[12] состоит из одноцепочечных левосторонних бета-спиралей, которые связываются в дальнейшем, чтобы создать левосторонний параллельный бета-валик с девятью спиралями (LPBR). Это самая плотная из известных структур бета-валков, обнаруженная первой. Головной домен YadA имеет восемь повторяющихся мотивов, по четырнадцать в каждом. остатки в длину.[8][13][14]
Кольцо trp
Кольцо Trp[15] является второй по распространенности головкой TAA. Trp - это аминокислота названный триптофан. Кольцо Trp получило свое название из-за высокого уровня триптофан находится в C-концевой части домена Head.[16] Они работают, стабилизируя переход между спиральной катушкой и бета-меандр где голова встречается с шеей или стеблем. Во многих случаях за кольцом Trp часто следует домен GIN.
ДЖИН
Домен GIN[17] является головным доменом, названным в честь его мотива последовательности GIN (Глицин-Изолейцин-Аспарагин), который имеет полностью бета-структуру, в результате чего две пары антипараллельный бета-листы связаны диагонально идущим расширенным бета-листом. Затем листы складываются, образуя бета-призму, каждая стенка которой состоит из пяти бета-прядей.[16] За доменом GIN часто следует шейный домен.
Область шеи
Структура: Шейный домен представляет собой гомотример, в котором связаны три одинаковых субъединицы. Все три субъединицы устроены таким образом, что напоминают структуру, подобную «английской булавке».[8]
Функция: Функция шейки - переходник между большим диаметром бета-спирали и меньший из спиральной катушки.[2] Кроме того, как и его конструкция с предохранительным штифтом, он также выполняет функцию скрепления всех трех мономеров вместе и прикрепляет их к области головы.[8] Это увеличивает стабильность шейного домена.
Существует семь различных типов шейных доменов.[11] Это следующие: ISneck1, ISneck2, коннектор HANS, DALL-1, DALL-2, DALL-3 и шейный домен. Эта запись посвящена домену ISneck.
ISneck домен
Домен ISneck - это разновидность шейного домена. Существует два типа домена ISneck. Это первый ISneck, который прерывается вставкой. Вставка может быть в сложенном виде (ISneck 1[18]) или намного короче, в разложенном виде (ISneck 2[19]) возмущение.[16]
Stalk домен
| YadA_stalk | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | YadA_stalk | ||||||||
| Pfam | PF05662 | ||||||||
| ИнтерПро | IPR008635 | ||||||||
| SCOP2 | 1с7м / Объем / СУПФАМ | ||||||||
| |||||||||
Структура: Эти домены имеют волокнистую структуру и встречаются в очень повторяющихся количествах. Они содержат спиральные спирали, и их длина может варьироваться у разных видов. Спиральные сегменты стеблевых доменов обладают двумя необычными свойствами:
- они чередуются от правых к левым суперспирализация
- часто прерываются небольшими шаровидными доменами, что связано с их появлением сегментированных веревок.[2]
Кроме того, стебель полностью состоит из пятидесятилеток. Следовательно, стеблевые домены можно рассматривать альфа спиральный спиральные бухты которые отличаются от стандартной модели из-за своих необычных свойств.[20] С более глубокой структурной точки зрения, спиральная катушка устроена таким образом, что угол пересечения спиралей почти равен нулю. Эти спирали укладываются по схеме «ручки в отверстия», в соответствии с которыми гидрофобный остатки выступают, образуя выступы, которые упаковываются в полости, образованные другими остатками на другой спирали. Затем, когда ручки упакованы в полости, три спирали наматываются друг на друга совмещенно, так что все остатки в определенных положениях находятся на одинаковой высоте.[16]
Функция: Их роль заключается в том, чтобы действовать как спейсеры, перемещая домены головки от поверхности бактериальных клеток в направлении внеклеточный матрикс из хозяин. Они также играют роль в защите бактериальной клетки от защиты хозяина.[2] Они делают это, помогая дополнять сопротивление. Домен белка стебля также альтернативно называют доменом внутреннего пассажира.[21]
Есть два типа стеблевых доменов:[11] домен FGG и домен правого стержня.
С-концевой мембранный якорный домен
| Якорный домен бактериального адгезина YadA | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Бета-цилиндрическая структура, обнаруженная на С-конце якорного домена бактериального адгезина, YadA[22] | |||||||||
| Идентификаторы | |||||||||
| Символ | YadA_anchor | ||||||||
| Pfam | PF03895 | ||||||||
| Pfam клан | CL0327 | ||||||||
| ИнтерПро | IPR005594 | ||||||||
| |||||||||
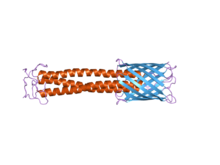
Структура: Структура этого белкового домена представляет собой левую спиральную спираль, за которой следуют четыре трансмембранных бета-нити. Считается, что после того, как произошла тримеризация, эти бета-цепи далее сворачиваются в 12-ти нитевую. бета-баррель. Он также содержит сайт распознавания сигнальных пептидаз, что означает, что фермент распознает сигнальный пептид и расщепляет его в определенной точке.[6]
Функция: Функция мембранный анкерный домен чтобы помочь движению полипептид цепь через клеточная мембрана, процесс, известный как деятельность по автотранспорту.[2] То, как TAA перемещаются через внешнюю мембрану, еще предстоит выяснить, но считается, что они перемещаются внутри бета-баррель, что приводит к транспортировке пассажирского домена от конца C к концу N через просвет бета-ствола.[3] По сути, бета-баррель - это порин что находится внутри бактериальная внешняя мембрана. В пассажирский домен или, другими словами, домен стебля в виде спиральной спирали перемещается через эту пору. Дополнительные функции мембранного якоря заключаются в олигомеризации стебельчатого домена и в закреплении всего белка к бактериальная внешняя мембрана.[23]
Модельные белки
Все адгезины тримерного автотранспорта являются решающими факторами вирулентности, вызывающими серьезные заболевания у людей. Наиболее изученные и известные адгезины-транспортеры тримеров перечислены ниже:[1]
- Яда из Yersinia enterocolitica
- НадА из Neisseria meningitidis
- УспА1 и А2 из Moraxella catarrhalis
- Hia и Hsf из Haemophilus influenzae
- Плохо Bartonella henselae
| Домен | Белки | |||||
|---|---|---|---|---|---|---|
| Яда | NadA | UspA1 | HadA | Привет | BadA | |
| N клемма Головка | Одноцепочечный, левосторонний бета-спираль[9] | Шаровидная голова[24] | Бета пропеллер голова[25] | Нет | Бета-призмы | Подобно голове YadA, содержит левую бета-спираль |
| Шея | Подарок | Нет | Подарок | Подарок | Подарок | Подарок |
| Стебель | Катушка правая | Спиральные альфа-спирали, за которыми следует линкерная область | Расширенная спиральная катушка | Три-альфа спираль спиральная катушка | Спиральная катушка с тремя альфа-спиралями | Расширенная спиральная катушка |
| Терминал C Мембранный анкер | Конструкция бета-ствола | Конструкция бета-ствола | Конструкция бета-ствола | Конструкция бета-ствола | Конструкция бета-ствола | Конструкция бета-ствола |
| Главный домен YadA | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллическая структура коллаген-связывающего домена Иерсиния адгезин Яда | |||||||||
| Идентификаторы | |||||||||
| Символ | YadA_head | ||||||||
| Pfam | PF05658 | ||||||||
| ИнтерПро | IPR008640 | ||||||||
| SCOP2 | 1п9ч / Объем / СУПФАМ | ||||||||
| |||||||||
Белок YadA
Яда представляет собой белковый домен, обнаруженный у грамотрицательных бактерий, таких как Иерсиния энтероколитика, Yersinia pestis, и Иерсиний псевдотуберкулез. YadA означает Иерсиния адгезиновый белок А. Этот белковый домен является примером тримерного аутотранспортера адгезинов, и это был первый обнаруженный ТАА.[26] Как и другие TAA, YadA также подвергается гомотримеризации с образованием стабильного коллаген-связывающий белок.[8] Гомотримеризация - это процесс, при котором три одинаковых субъединицы связываются с образованием комплекса из трех идентичных белков YadA. Более того, как и другие TAA, он имеет архитектуру белка "голова-стебель-якорь".[9] Большинство TAA обладают сильным сходством в области якоря C-концевой мембраны, единственный член, который отличается в TAA, - это области головы, шеи и стебля. Головная область YadA состоит из бета-спиралей, дополнительно свернутых, чтобы создать левосторонний параллельный бета-валик с девятью спиралями (LPBR).[8]
Протеин NadA
Другой пример TAA - белок NadA. Белок NadA обнаружен в виде грамотрицательных бактерий, называемых Neisseria meningitidis, что приводит к сепсис и менингит в людях.[27] Исследования показали, что глобулярный N-концевой головной домен NadA жизненно важен для адгезии. NadA также содержит область спиральной спирали, а также С-концевой мембранный якорь.[24]
Белок UspA1
UspA1 - еще один пример тримерного автотранспорта адгезина, обнаруженного в бактерии. Moraxella catarrhalis, встречается как частая причина среднее ухо инфекции у людей. Структура UspA1 также имеет головной домен в N-концевом домене, однако он свернут в бета-пропеллер. Подобно другим TAA, он имеет стеблевую область в виде спиральной спирали, но в этом случае он расширен, и он имеет типичный для TAA С-концевой бета-стволовый домен якоря мембраны.[25]
Протеин Hia
Белок Hia - это TAA, обнаруженный на внешней мембране бактерии. Haemophilus influenzae. Он придерживается респираторный эпителий в людях.[28] Этот белок может вызывать пневмония и некоторые штаммы вызывают менингит и сепсис.[29] У Hia немного необычная N-концевая головка, сделанная из бета-призм. Бета-призма - это необычный тип белковой архитектуры, впервые описанный Chothia и Мурзин.[30] Как следует из названия, в нем три бета-листы расположены в треугольной призме и содержат внутреннюю симметрию.[31] Кроме того, головной домен содержит 5 доменов Trp-Ring. Кроме того, этот белок также содержит три шейных домена, два из которых являются доменами IsNeck в дополнение к другим доменам, таким как домены KG, GANG и TTT.[29] Он также содержит стержень в виде спиральной спирали и обычно консервативный концевой мембранный якорь TAA C.[32]
BadA белок
Белок BadA - еще один пример TAA, обнаруженный в Bartonella henselae бактерии. Bartonella henselae является возбудителем болезнь кошачьих царапин, обычно безвредное заболевание, но у людей с ослабленным иммунная система, например, проходящие химиотерапия или борьба СПИД, это более серьезно, так как это может привести к бациллярный ангиоматоз.[1] Это условие, при котором доброкачественный опухоли из кровеносный сосуд подвергаться неконтролируемому распространение, вызывая образование узлов в более мелких кровеносных сосудах, таких как капилляры, ограничивая кровоток. Это может быть связано с тем, что BadA индуцирует транскрипцию проангиогенный факторов, поскольку он активирует NF-κB а также фактор, индуцируемый гипоксией 1.[33] Головной домен BadA более сложен, чем другие TAA. Считается, что это химера или, другими словами, комбинация головных доменов YadA и Hia.[1] Эта комбинация дает представление о том, как патогенность грамотрицательных бактерий развился через некоторое время. BadA также содержит шейный домен, удлиненный стержень катушки-катушки и бета-цилиндрический С-концевой мембранный якорь.
Клинические эффекты
| Белковый домен | Бактериальные виды | Заболевания, вызванные |
|---|---|---|
| Яда | Yersinia enterocolitica | иерсиниоз |
| NadA | Neisseria meningitidis | сепсис и менингит |
| UspA1 | Moraxella catarrhalis | инфекция среднего уха |
| Привет | Haemophilus influenzae | пневмония и некоторые штаммы вызывают менингит и сепсис |
| BadA | Bartonella henselae | болезнь кошачьих царапин |
Процесс заражения
Процесс заражения сложен. Инвазивная бактерия должна преодолеть множество барьеров, чтобы заразить своего хозяина, включая барьеры окружающей среды, физические барьеры и иммунная система барьеры. Бактерия должна проникнуть в организм хозяина и, в случае Yersinia sp., вторгнуться в хозяин кишечный слизистая оболочка. Затем тримерный автотранспортер адгезин должен прилипнуть к слою клеток, обнаруженных на внутренней поверхности, т.е. эпителиальные клетки, в кишечнике, используя головку для связывания с белками, содержащимися в внеклеточный матрикс Такие как коллаген, ламинин, и фибронектин.[8] Важно, чтобы эти адгезины внешней мембраны вступали в физический контакт с рецепторами, обнаруженными на клетке-хозяине. Это означает, что адгезин должен быть достаточно длинным, чтобы выходить за пределы липополисахарид слоя во внешней мембране бактерии и взаимодействуют с гликан слой клетки-хозяина.[29]Как только это произойдет, он может связываться с ЕСМ клетки-хозяина. TAA - это тип ммикробный sтвое лицо cкомпоненты рпознающий алипкий матрикс ммолекулы (МСКРАММ). Другими словами, они представляют собой комплекс, который способствует прилипанию к ECM.[34]
Система секреции типа V (T5SS)

Схематическая диаграмма, иллюстрирующая тримерный автотранспортер адгезинов типа V Секреция Система.
Секреция это один из методов передачи веществ через бактериальная внешняя мембрана. У грамотрицательных бактерий очень разные структуры клеточной стенки по сравнению с грамположительными бактериями. Грамотрицательные бактерии имеют три слоя: самый внутренний слой называется внутренняя мембрана; средний слой, названный периплазматическое пространство, это пространство, содержащее тонкий слой пептидогликан; а третий слой называется внешняя мембрана, который содержит липополисахариды.[23]
У грамотрицательных бактерий секретарный путь сильно отличается от такового у грамотрицательных бактерий. эукариоты или же Грамположительный бактерии, в основном из-за разницы в структуре клеточной стенки.[35] Тримерный аутотранспортер Адгезины используют особый путь секреции, названный система секреции типа V (T5SS). Грамотрицательные бактерии должны секретировать адгезины, так как у них есть внешняя мембрана, которая затрудняет им прилипание и заражение хозяина. Внешняя мембрана полезна, так как позволяет бактериям колонизировать и добавляет еще один уровень защиты. Однако внешняя мембрана является барьером для секреции белков, и для транспортировки белков через внешнюю мембрану требуется энергия. Следовательно, путь T5SS преодолевает эту проблему.[35]
T5SS использует для работы систему Sec-machinery. В фермент Обнаружено присутствие Sec-транслоказы на внутренняя мембрана. Такие Sec-зависимые системы не нуждаются в использовании энергии, в отличие от Sec-независимых машин, которые используют другие формы энергии, такие как аденозинтрифосфат (ATP) или протон градиент. Поскольку он может транспортировать предметы через внешнюю мембрану без необходимости генерировать новую форму энергии, он получил название автовоз, поскольку транспортирует белки автономно,[36] другими словами, само по себе.
Sec-зависимая система делится на три пути. TAA - один из таких путей, также известный под названием путь секреции типа Vc. Механизм разделен на две части. Во-первых, белок должен перемещаться через внутреннюю мембрану или, другими словами, перемещаться Sec-зависимым образом через периплазма.[37] Сигнальный пептид на N-конце действует как временная связка, удерживая его на месте. Затем он должен перейти к внешней мембране. Тримеризация способствует транслокации, и никакая транслокация не произошла бы без его якоря бета-ствола мембраны.[3] Система секреции типа V описывается как нефимбритовая, что означает, что бактериальные клетки не используют длинные физические придатки, названные пили прикрепить друг к другу.[6]
Уклонение от иммунной системы хозяина
TAA могут помочь предотвратить уничтожение бактерий иммунной системой хозяина. В частности, в случае некоторых Yersinia spp., TAA YadA играет роль в аутоагглютинация, сыворотка сопротивление, инактивация комплемента, и фагоцитоз сопротивление. Все эти методы предотвращают уничтожение бактерий хозяином и обеспечивают его выживание.[8]
Смотрите также
Рекомендации
- ^ а б c d е ж Щесны П., Линке Д., Урсинус А., Бэр К., Шварц Х., Рисс TM и др. (2008). Гош П. (ред.). «Строение головки бартонеллы адгезина BadA». PLOS Pathog. 4 (8): e1000119. Дои:10.1371 / journal.ppat.1000119. ЧВК 2483945. PMID 18688279.
- ^ а б c d е ж грамм час Linke D, Riess T, Autenrieth IB, Lupas A, Kempf VA (2006). «Тримерный аутотранспортер адгезинов: переменная структура, общая функция». Тенденции Microbiol. 14 (6): 264–70. Дои:10.1016 / j.tim.2006.04.005. PMID 16678419.
- ^ а б c Микула К.М., Лео Дж. К., Лысковски А., Кедрацка-Крок С., Пирог А., Голдман А. (2012). «Домен транслокации в тримерных аутотранспортерах адгезинов необходим и достаточен для тримеризации и аутотранспортации». J Бактериол. 194 (4): 827–38. Дои:10.1128 / JB.05322-11. ЧВК 3272944. PMID 22155776.
- ^ Щесны П., Лупас А. (2008). «Доменная аннотация тримерных автотранспортеров адгезинов - daTAA». Биоинформатика. 24 (10): 1251–6. Дои:10.1093 / биоинформатика / btn118. ЧВК 2373917. PMID 18397894.
- ^ Десво М., Скотт-Такер А., Тернер С. М., Купер Л. М., Хубер Д., Натаро Дж. П. и др. (2007). «Консервативная расширенная область сигнального пептида управляет посттрансляционной транслокацией белка с помощью нового механизма». Микробиология. 153 (Pt 1): 59–70. Дои:10.1099 / мик. 0.29091-0. PMID 17185535.
- ^ а б c Лейтон Д.Л., Росситер А.Е., Хендерсон И.Р. (2012). «От самодостаточности к зависимости: механизмы и факторы, важные для биогенеза аутотранспортеров». Нат Рев Микробиол. 10 (3): 213–25. Дои:10.1038 / nrmicro2733. PMID 22337167. S2CID 19562964.
- ^ а б Desvaux M, Cooper LM, Filenko NA, Scott-Tucker A, Turner SM, Cole JA, et al. (2006). «Необычная протяженная область сигнального пептида системы секреции типа V ограничена филогенетически». FEMS Microbiol Lett. 264 (1): 22–30. Дои:10.1111 / j.1574-6968.2006.00425.x. PMID 17020545.
- ^ а б c d е ж грамм час Нуммелин Х., Меркель М.С., Лео Дж. К., Ланкинен Х., Скурник М., Гольдман А (2004). «Структура коллаген-связывающего домена Yersinia adhesin YadA представляет собой новый левосторонний параллельный бета-валик». EMBO J. 23 (4): 701–11. Дои:10.1038 / sj.emboj.7600100. ЧВК 381008. PMID 14765110.
- ^ а б c Коретке К.К., Щесны П., Грубер М., Лупас А.Н. (2006). «Модельная структура прототипа нефимбриального адгезина YadA Yersinia enterocolitica». J Struct Biol. 155 (2): 154–61. Дои:10.1016 / j.jsb.2006.03.012. PMID 16675268.
- ^ Эдвардс Т.Э., Фан И., Абендрот Дж., Дитрих С.Х., Масуди А., Гуо В. и др. (2010). Курсула П. (ред.). «Структура адгезиновой головки тримерного автотранспорта Burkholderia pseudomallei». PLOS ONE. 5 (9): e12803. Bibcode:2010PLoSO ... 512803E. Дои:10.1371 / journal.pone.0012803. ЧВК 2942831. PMID 20862217.
- ^ а б c http://toolkit.tuebingen.mpg.de/dataa/browse[требуется полная цитата]
- ^ http://toolkit.tuebingen.mpg.de/dataa/browse?page=show&domain=20&db=domains[требуется полная цитата]
- ^ Валле Дж., Маббетт А.Н., Улетт Г.К., Толедо-Арана А., Веккер К., Тоцика М. и др. (2008). «UpaG, новый член семейства тримерных автотранспортеров адгезинов в уропатогенной Escherichia coli». J Бактериол. 190 (12): 4147–61. Дои:10.1128 / JB.00122-08. ЧВК 2446758. PMID 18424525.
- ^ Казерта Р., Такита М.А., Таргон М.Л., Росселли-Мураи Л.К., де Соуза А.П., Перони Л. и др. (2010). «Экспрессия фимбриальных и афимбриальных белков Xylella fastidiosa во время образования биопленок». Appl Environ Microbiol. 76 (13): 4250–9. Дои:10.1128 / AEM.02114-09. ЧВК 2897468. PMID 20472735.
- ^ http://toolkit.tuebingen.mpg.de/dataa/browse?page=show&domain=2&db=domains[требуется полная цитата]
- ^ а б c d Łyskowski A, Leo JC, Goldman A (2011). «Структура и биология тримерных автотранспортерных адгезинов». Adv Exp Med Biol. Успехи экспериментальной медицины и биологии. 715: 143–58. Дои:10.1007/978-94-007-0940-9_9. ISBN 978-94-007-0939-3. PMID 21557062.
- ^ http://toolkit.tuebingen.mpg.de/dataa/browse?page=show&domain=11&db=domains[требуется полная цитата]
- ^ http://toolkit.tuebingen.mpg.de/dataa/browse?page=show&domain=16&db=domains[требуется полная цитата]
- ^ http://toolkit.tuebingen.mpg.de/dataa/browse?page=show&domain=22&db=domains[требуется полная цитата]
- ^ Лупас А.Н., Грубер М. (2005). «Структура альфа-спиральных спиральных катушек». Adv Protein Chem. Успехи в химии белков. 70: 37–78. Дои:10.1016 / S0065-3233 (05) 70003-6. ISBN 9780120342709. PMID 15837513.
- ^ Cotter, S.E .; Surana, N.K .; Сент-Джем, Дж. У. (2005). «Тримерные автотранспортеры: отдельное подсемейство белков-транспортеров». Тенденции в микробиологии. 13 (5): 199–205. Дои:10.1016 / j.tim.2005.03.004. PMID 15866036.
- ^ http://www.ebi.ac.uk/thornton-srv/databases/cgi-bin/pdbsum/GetPage.pl[требуется полная цитата]
- ^ а б Бялас Н, Касперкевич К, Радзеевская-Лебрехт Дж, Скурник М (2012). «Структуры поверхности бактериальных клеток в Yersinia enterocolitica». Arch Immunol Ther Exp (Warsz). 60 (3): 199–209. Дои:10.1007 / s00005-012-0168-z. PMID 22484801. S2CID 10237335.
- ^ а б Тавано Р., Капеччи Б., Монтанари П., Франзосо С., Марин О., Штуковска М. и др. (2011). «Картирование сайта связывания клетки Neisseria meningitidis NadA: релевантность предсказанных {альфа} -спиралей в NH2-концевых и димерных областях спиральной спирали». J Бактериол. 193 (1): 107–15. Дои:10.1128 / JB.00430-10. ЧВК 3019930. PMID 20971901.
- ^ а б Агнью С., Бородина Э., Заккаи Н.Р., Коннерс Р., Бертон Н.М., Викари Дж. А. и др. (2011). «Корреляция in situ механочувствительных ответов адгезина UspA1 Moraxella catarrhalis с фибронектином и связыванием рецептора CEACAM1». Proc Natl Acad Sci U S A. 108 (37): 15174–8. Bibcode:2011PNAS..10815174A. Дои:10.1073 / pnas.1106341108. ЧВК 3174611. PMID 21876142.
- ^ Casutt-Meyer S, Renzi F, Schmaler M, Jann NJ, Amstutz M, Cornelis GR (2010). Бересвилл, Стефан (ред.). «Олигомерный спиральный адгезин YadA - палка о двух концах». PLOS ONE. 5 (12): e15159. Bibcode:2010PLoSO ... 515159C. Дои:10.1371 / journal.pone.0015159. ЧВК 2999546. PMID 21170337.CS1 maint: несколько имен: список авторов (связь)
- ^ Командуччи М., Бамбини С., Брунелли Б., Аду-Боби Дж., Арико Б., Капеччи Б. и др. (2002). «NadA, новый кандидат на вакцину против Neisseria meningitidis». J Exp Med. 195 (11): 1445–54. Дои:10.1084 / jem.20020407. ЧВК 2193550. PMID 12045242.
- ^ Мэн Г., Сурана Н.К., Сент-Геме Дж. В., Ваксман Г. (2006). «Структура транслокаторного домена внешней мембраны тримерного аутотранспортера Haemophilus influenzae Hia». EMBO J. 25 (11): 2297–304. Дои:10.1038 / sj.emboj.7601132. ЧВК 1478200. PMID 16688217.
- ^ а б c Мэн Дж., Сент-Джем Дж. У., Ваксман Дж. (2008). «Повторяющаяся архитектура тримерного автотранспорта Haemophilus influenzae Hia». Дж Мол Биол. 384 (4): 824–36. Дои:10.1016 / j.jmb.2008.09.085. ЧВК 2597055. PMID 18948113.
- ^ Андреева А, Мурзин АГ (2010). «Структурная классификация белков и структурная геномика: новое понимание сворачивания и эволюции белков». Acta Crystallogr F. 66 (Пт 10): 1190–7. Дои:10.1107 / S1744309110007177. ЧВК 2954204. PMID 20944210.
- ^ Симидзу Т., Морикава К. (1996). «Бета-призма: новый складной мотив». Тенденции Biochem Sci. 21 (1): 3–6. Дои:10.1016 / s0968-0004 (06) 80018-6. PMID 8848836.
- ^ Сурана Н.К., Каттер Д., Баренкамп С.Дж., Сен-Жемчужина Ю.В. (2004). «Автотранспортер Haemophilus influenzae Hia содержит необычно короткий тримерный транслокаторный домен». J Biol Chem. 279 (15): 14679–85. Дои:10.1074 / jbc.M311496200. PMID 14726537.
- ^ Хармс А., Дехио С. (2012). «Злоумышленники вне поля зрения: молекулярный патогенез Bartonella spp». Clin Microbiol Rev. 25 (1): 42–78. Дои:10.1128 / CMR.05009-11. ЧВК 3255967. PMID 22232371.
- ^ Харрис Л.Г., Ричардс Р.Г. (2006). «Стафилококки и поверхности имплантатов: обзор». Травма, повреждение. 37 Дополнение 2 (2): S3–14. Дои:10.1016 / j.injury.2006.04.003. PMID 16651069.
- ^ а б Герлах Р.Г., Хенсель М. (2007). «Системы секреции белков и адгезины: молекулярный арсенал грамотрицательных патогенов». Int J Med Microbiol. 297 (6): 401–15. Дои:10.1016 / j.ijmm.2007.03.017. PMID 17482513.
- ^ Лео Дж. К., Грин I, Линке Д. (2012). «Секреция типа V: механизм (ы) аутотранспорта через бактериальную внешнюю мембрану». Philos Trans R Soc Lond B Biol Sci. 367 (1592): 1088–101. Дои:10.1098 / rstb.2011.0208. ЧВК 3297439. PMID 22411980.
- ^ Костакиоти М., Ньюман К.Л., Танасси Д.Г., Статопулос К. (2005). «Механизмы экспорта белка через внешнюю мембрану бактерий». J Бактериол. 187 (13): 4306–14. Дои:10.1128 / JB.187.13.4306-4314.2005. ЧВК 1151778. PMID 15968039.