WikiDer > Кристаллизационная вода
В химии, вода (и) кристаллизации или же вода (и) гидратации находятся воды молекулы которые присутствуют внутри [кристалла] s. Вода часто участвует в образовании кристаллов из водные растворы.[1] В некоторых случаях вода кристаллизация это общая масса воды в вещество при данной температуре и в основном присутствует в определенных (стехиометрический) соотношение. Классически «кристаллизационная вода» относится к воде, которая содержится в кристаллический каркас из металлический комплекс или соль, что напрямую не связанный к металлу катион.
На кристаллизация из воды или сырости растворители, много соединения включают молекулы воды в свои кристаллические структуры. Кристаллизационную воду обычно можно удалить нагреванием образца, но кристаллические свойства часто теряются. Например, в случае хлорида натрия дигидрат нестабилен при комнатной температуре.

В сравнении с неорганические соли, белки кристаллизуются с большим количеством воды в кристаллической решетке. Содержание воды в 50% не является редкостью для белков.
Номенклатура
В молекулярные формулы кристаллизационная вода указывается по-разному, но часто расплывчато. Термины "гидратированное соединение" и "гидрат" обычно нечетко определены.
Положение в кристаллической структуре

А соль с связанной водой кристаллизации известен как гидрат. Структура гидратов может быть довольно сложной из-за наличия водородные связи которые определяют полимерные структуры.[3][4]Исторически структура многих гидратов была неизвестна, и точка в формуле гидрата использовалась для определения состава без указания того, как связана вода. Примеры:
- CuSO4 • 5H2О - пентагидрат сульфата меди (II)
- CoCl2 • 6H2О - гексагидрат хлорида кобальта (II)
- SnCl2 • 2H2О - олово (II) (или же двухвалентное олово) хлорид дигидрат
Для многих солей точное связывание воды не имеет значения, потому что молекулы воды лабилизированный при роспуске. Например, водный раствор, приготовленный из CuSO4 • 5H2O и безводный CuSO4 вести себя идентично. Поэтому знание степени гидратации важно только для определения эквивалентный вес: один моль CuSO4 • 5H2O весит более одного моля CuSO4. В некоторых случаях степень гидратации может иметь решающее значение для получаемых химических свойств. Например, безводный RhCl3 не растворяется в воде и относительно бесполезен в металлоорганической химии, тогда как RhCl3 • 3H2O универсален. Аналогичным образом гидратированный AlCl3 бедный Кислота Льюиса и поэтому неактивен в качестве катализатора Реакции Фриделя-Крафтса. Образцы AlCl3 поэтому должны быть защищены от атмосферной влаги, чтобы предотвратить образование гидратов.
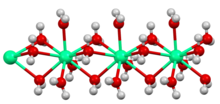
Кристаллы гидратированного сульфата меди (II) состоят из [Cu (H2O)4]2+ центров, связанных с SO42− ионы. Медь окружена шестью атомами кислорода, представленными двумя различными сульфатными группами и четырьмя молекулами воды. Пятая вода находится в другом месте каркаса, но не связывается напрямую с медью.[5] Упомянутый выше хлорид кобальта встречается как [Co (H2O)6]2+ и Cl−. В хлориде олова каждый центр Sn (II) пирамидальный (средний угол O / Cl-Sn-O / Cl составляет 83 °) и связан с двумя ионами хлорида и одним водой. Вторая вода в формульной единице связана водородными связями с хлоридом и координированной молекулой воды. Кристаллизационная вода стабилизируется электростатическим притяжением, следовательно, гидраты обычны для солей, содержащих катионы +2 и +3, а также анионы -2. В некоторых случаях большая часть веса соединения приходится на воду. Глауберова соль, Na2ТАК4(ЧАС2O)10, представляет собой белое кристаллическое твердое вещество с содержанием воды более 50% по весу.
Рассмотрим случай хлорид никеля (II) гексагидрат. Этот вид имеет формулу NiCl2(ЧАС2O)6. Кристаллографический анализ показывает, что твердое тело состоит из [транс-NiCl2(ЧАС2O)4] подразделения, которые водородная связь друг к другу, а также две дополнительные молекулы H2О. Таким образом, 1/3 молекул воды в кристалле не связаны напрямую с Ni.2+, и их можно было бы назвать «кристаллизационной водой».
Анализ
Содержание воды в большинстве соединений можно определить, зная его формулу. Неизвестный образец можно определить с помощью термогравиметрический анализ (TGA), когда образец сильно нагревается, и точный вес образца наносится на график в зависимости от температуры. Затем количество удаленной воды делится на молярную массу воды, чтобы получить количество молекул воды, связанных с солью.
Другие растворители кристаллизации
Вода - особенно распространенный растворитель, который можно найти в кристаллах, потому что он маленький и полярный. Но все растворители можно найти в некоторых кристаллах-хозяевах. Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол считаются химически безвредными. Иногда в кристалле обнаруживается более одного растворителя, и часто стехиометрия варьируется, что отражается в кристаллографической концепции «частичного заполнения». Химик обычно «сушит» образец в сочетании с вакуумом и нагреванием «до постоянного веса».
Для других растворителей кристаллизации анализ удобно выполнять, растворяя образец в дейтерированном растворителе и анализируя образец на наличие сигналов растворителя путем ЯМР-спектроскопия. Рентгеновская кристаллография монокристаллов также часто позволяет обнаружить присутствие этих растворителей кристаллизации. В настоящее время могут быть доступны другие методы.
Таблица кристаллизационной воды в некоторых неорганических галогенидах
В таблице ниже указано количество молекул воды на металл в различных солях.[6][7]
| Формула гидратированные галогениды металлов | Координация сфера из металла | Эквиваленты кристаллизационной воды которые не связаны с M | Замечания | |
|---|---|---|---|---|
| CaCl2(ЧАС2O)6 | [Ca (мк-H2O)6(ЧАС2O)3]2+ | никто | Случай воды как мостикового лиганда[8] | |
| VCl3(ЧАС2O)6 | транс- [VCl2(ЧАС2O)4]+[9] | два | ||
| VBr3(ЧАС2O)6 | транс- [VBr2(ЧАС2O)4]+[9] | два | бромиды и хлориды обычно похожи | |
| VI3(ЧАС2O)6 | [V (H2O)6]3+ | никто | йодид плохо конкурирует с водой (M6Xi2) (H20) 4X2] -4H20 | |
| Nb6Cl14(ЧАС2O)8 | [Nb6Cl14(ЧАС2O)2] | четыре | ||
| CrCl3(ЧАС2O)6 | транс- [CrCl2(ЧАС2O)4]+ | два | темно-зеленый изомер, он же «соль Бьеррума» | |
| CrCl3(ЧАС2O)6 | [CrCl (H2O)5]2+ | один | сине-зеленый изомер | |
| CrCl2(ЧАС2O)4 | транс- [CrCl2(ЧАС2O)4] | никто | квадратно-планарное / тетрагональное искажение | |
| CrCl3(ЧАС2O)6 | [Cr (H2O)6]3+ | никто | [10] | |
| AlCl3(ЧАС2O)6 | [Al (H2O)6]3+ | никто | изоструктурен соединению Cr (III) | |
| MnCl2(ЧАС2O)6 | транс- [MnCl2(ЧАС2O)4] | два | ||
| MnCl2(ЧАС2O)4 | СНГ- [MnCl2(ЧАС2O)4] | никто | цис-молекулярный, нестабильный транс-изомер также был обнаружен[11] | |
| MnBr2(ЧАС2O)4 | СНГ- [MnBr2(ЧАС2O)4] | никто | цис, молекулярный | |
| MnCl2(ЧАС2O)2 | транс- [MnCl4(ЧАС2O)2] | никто | полимерный с мостиковым хлоридом | |
| MnBr2(ЧАС2O)2 | транс- [MnBr4(ЧАС2O)2] | никто | полимерный с мостиковым бромидом | |
| FeCl2(ЧАС2O)6 | транс- [FeCl2(ЧАС2O)4] | два | ||
| FeCl2(ЧАС2O)4 | транс- [FeCl2(ЧАС2O)4] | никто | молекулярный | |
| FeBr2(ЧАС2O)4 | транс- [FeBr2(ЧАС2O)4] | никто | молекулярный | |
| FeCl2(ЧАС2O)2 | транс- [FeCl4(ЧАС2O)2] | никто | полимерный с мостиковым хлоридом | |
| FeCl3(ЧАС2O)6 | транс- [FeCl2(ЧАС2O)4]+ | два | один из четырех гидратов хлорид железа,[12] изоструктурный с аналогом Cr | |
| FeCl3(ЧАС2O)2.5 | СНГ- [FeCl2(ЧАС2O)4]+ | два | дигидрат имеет аналогичную структуру, оба содержат FeCl4− анионы.[12] | |
| CoCl2(ЧАС2O)6 | транс- [CoCl2(ЧАС2O)4] | два | ||
| CoBr2(ЧАС2O)6 | транс- [CoBr2(ЧАС2O)4] | два | ||
| CoI2(ЧАС2O)6 | [Co (H2O)6]2+ | никто[13] | йодид плохо конкурирует с водой | |
| CoBr2(ЧАС2O)4 | транс- [CoBr2(ЧАС2O)4] | никто | молекулярный | |
| CoCl2(ЧАС2O)4 | СНГ- [CoCl2(ЧАС2O)4] | никто | Примечание: цис-молекулярный | |
| CoCl2(ЧАС2O)2 | транс- [CoCl4(ЧАС2O)2] | никто | полимерный с мостиковым хлоридом | |
| CoBr2(ЧАС2O)2 | транс- [CoBr4(ЧАС2O)2] | никто | полимерный с мостиковым бромидом | |
| NiCl2(ЧАС2O)6 | транс- [NiCl2(ЧАС2O)4] | два | ||
| NiCl2(ЧАС2O)4 | СНГ- [NiCl2(ЧАС2O)4] | никто | Примечание: цис-молекулярный | |
| NiBr2(ЧАС2O)6 | транс- [NiBr2(ЧАС2O)4] | два | ||
| NiI2(ЧАС2O)6 | [Национальные институты здравоохранения США2O)6]2+ | никто[13] | йодид плохо конкурирует с водой | |
| NiCl2(ЧАС2O)2 | транс- [NiCl4(ЧАС2O)2] | никто | полимерный с мостиковым хлоридом | |
| CuCl2(ЧАС2O)2 | [CuCl4(ЧАС2O)2]2 | никто | тетрагонально искаженный два больших расстояния Cu-Cl | |
| CuBr2(ЧАС2O)4 | [CuBr4(ЧАС2O)2]п | два | тетрагонально искаженный два больших расстояния Cu-Br | |
| ZnCl2(ЧАС2O)1.33[14] | 2 ZnCl2 + ZnCl2(ЧАС2O)4 | никто | координационный полимер с тетраэдрическими и октаэдрическими центрами Zn | |
| ZnCl2(ЧАС2O)2.5[15] | Cl3Zn (μ-Cl) Zn (H2O)5 | никто | тетраэдрические и октаэдрические центры Zn | |
| ZnCl2(ЧАС2O)3[16] | [ZnCl4]2- + Zn (H2O)6]2+ | никто | тетраэдрические и октаэдрические центры Zn | |
| ZnCl2(ЧАС2O)4.5[17] | [ZnCl4]2- + [Zn (H2O)6]2+ | три | тетраэдрические и октаэдрические центры Zn |
Гидраты сульфатов металлов
Сульфаты переходных металлов образуют множество гидратов, каждый из которых кристаллизуется только в одной форме. Сульфатная группа часто связывается с металлом, особенно для солей с менее чем шестью акво-лиганды. Гептагидраты, которые часто являются наиболее распространенными солями, кристаллизуются в моноклинных и менее распространенных орторомбических формах. В гептагидратах одна вода находится в решетке, а шесть других координированы с центром железа.[18] Многие сульфаты металлов встречаются в природе в результате выветривания сульфидов минералов.[19]
| Формула гидратированный сульфат иона металла | Координация сфера иона металла | Эквиваленты кристаллизационной воды которые не связаны с M | название минерала | Замечания |
|---|---|---|---|---|
| MgSO4(ЧАС2O)6 | [Mg (H2O)6] | никто | гексагидрит | общий мотив[19] |
| MgSO4(ЧАС2O)7 | [Mg (H2O)6] | один | эпсомит | общий мотив[19] |
| TiOSO4(ЧАС2O) | [Ti (μ-O)2(ЧАС2O) (κ1-ТАК4)3] | никто | дальнейшее увлажнение дает гели | |
| VSO4(ЧАС2O)6 | [V (H2O)6] | никто | Использует мотив гексагидрита[20] | |
| ВОСО4(ЧАС2O)5 | [VO (H2O)4(κ1-ТАК4)4] | один | ||
| Cr2(ТАК4)3(ЧАС2O)18 | [Cr (H2O)6] | шесть | Один из нескольких сульфатов хрома (III) | |
| MnSO4(ЧАС2O) | [Mn (μ-H2O)2(κ1-ТАК4)4][21] | никто | Самый распространенный из нескольких гидратированных сульфатов марганца (II) | |
| FeSO4(ЧАС2O)7 | [Fe (H2O)6] | один | мелантерит | см. аналог Mg |
| CoSO4(ЧАС2O)7 | [Co (H2O)6] | один | см. аналог Mg | |
| NiSO4(ЧАС2O)7 | [Национальные институты здравоохранения США2O)6] | один | морозит | см. аналог Mg |
| NiSO4(ЧАС2O)6 | [Национальные институты здравоохранения США2O)6] | никто | ретгерсит | Один из нескольких гидратов сульфата никеля[22] |
| CuSO4(ЧАС2O)5 | [Cu (H2O)4(κ1-ТАК4)2] | один | халькантит | сульфат является мостиковым лигандом[23] |
| CdSO4(ЧАС2O) | [Cd (мк-H2O)2(κ1-ТАК4)4] | никто | мосты воды лиганд[24] |
Фото
Гидратированный сульфат меди (II) ярко-синий.
Смотрите также
Рекомендации
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Klewe, B .; Педерсен, Б. (1974). «Кристаллическая структура дигидрата хлорида натрия». Acta Crystallographica B. 30 (10): 2363–2371. Дои:10.1107 / S0567740874007138.
- ^ Yonghui Wang et al. "Новые трехмерные сети с водородными связями, инкапсулирующие одномерные ковалентные цепи: ..." Неорг. Chem., 2002, 41 (24), стр. 6351–6357. Дои:10.1021 / ic025915o
- ^ Кармен Р. Мальдонадоа, Мигель Кирос и Х.М. Салас: «Формирование 2D морфологии воды в решетке соли ...» Связь по неорганической химии Том 13, выпуск 3, март 2010 г., стр. 399–403; Дои:10.1016 / j.inoche.2009.12.033
- ^ Меллер, Теральд (1 января 1980 г.). Химия: с неорганическим качественным анализом. Academic Press Inc (London) Ltd. стр. 909. ISBN 978-0-12-503350-3. Получено 15 июн 2014.
- ^ К. Вайзуми, Х. Масуда, Х. Отаки, «Рентгеноструктурные исследования FeBr.2 • 4H2O, CoBr2 • 4H2O, NiCl2 • 4H2O и CuBr2 • 4H2O. цис / транс-селективность в тетрагидрате дигалогенида переходного металла (I1) » Неорганика Chimica Acta, 1992, том 192, страницы 173–181.
- ^ Б. Морозин "Рентгеноструктурное исследование дигидрата хлорида никеля (II)" Acta Crystallogr. 1967. том 23, стр. 630-634. Дои:10.1107 / S0365110X67003305
- ^ Agron, P.A .; Бусинг, W.R. "Гексагидраты дихлорида кальция и стронция методом нейтронографии" Acta Crystallographica Section C 1986, volume 42, pp. 141-p1.
- ^ а б Донован, Уильям Ф .; Смит, Питер В. (1975). «Кристаллическая и молекулярная структура комплексов аквагалогенованадия (III). Часть I. Рентгеновская кристаллическая структура транс-Тетракисквадибром-ванадий (III) бромид дигидрат и изоморфное хлор-соединение ». Журнал химического общества, Dalton Transactions (10): 894. Дои:10.1039 / DT9750000894.
- ^ фиолетовый изомер. изоструктурен из компаунда алюминия.Andress, K.R .; Карпентер, К. "Кристаллгидрат. II.Die Struktur von Chromchlorid- und Aluminiumchloridhexahydrat" Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie 1934, volume 87, p446-p463.
- ^ Залкин, Аллан; Forrester, J.D .; Темплтон, Дэвид Х. (1964). «Кристаллическая структура тетрагидрата дихлорида марганца». Неорганическая химия. 3 (4): 529–33. Дои:10.1021 / ic50014a017.
- ^ а б Саймон А. Коттон (2018). «Хлорид железа (III) и его координационная химия». Журнал координационной химии. 71 (21): 3415–3443. Дои:10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ а б "Structure Cristalline et Expansion Thermique de L’Iodure de Nickel Hexahydrate" (Кристаллическая структура и тепловое расширение гексагидрата иодида никеля (II)) Louër, Michele; Гранджан, Дэниел; Вейгель, Журнал Доминика по химии твердого тела (1973), 7 (2), 222-8. Дои: 10.1016/0022-4596(73)90157-6
- ^ . Дои:10.1107 / S0567740870004715. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ . Дои:10.1107 / S1600536814024738. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ . Дои:10.1107 / S0567740870004715. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ . Дои:10.1107 / S0567740870004715. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ Баур, W.H. «О кристаллохимии солевых гидратов. III. Определение кристаллической структуры FeSO.4(ЧАС2O)7 (мелантерит) "Acta Crystallographica 1964, том 17, p1167-p1174. Дои:10.1107 / S0365110X64003000
- ^ а б c Чжоу, И-Мин; Печать, Роберт Р .; Ван, Алиан (2013). «Стабильность сульфатных и гидратированных сульфатных минералов вблизи условий окружающей среды и их значение в экологических и планетарных науках». Журнал азиатских наук о Земле. 62: 734–758. Bibcode:2013JAESc..62..734C. Дои:10.1016 / j.jseaes.2012.11.027.
- ^ Коттон, Ф. Альберт; Фалвелло, Ларри Р .; Ллусар, Роза; Либби, Эдуардо; Мурильо, Карлос А .; Швотцер, Вилли (1986). «Синтез и характеристика четырех соединений ванадия (II), включая гексагидрат сульфата ванадия (II) и сахаринаты ванадия (II)». Неорганическая химия. 25 (19): 3423–3428. Дои:10.1021 / ic00239a021.
- ^ Вильднер, М .; Гистер, Г. (1991). «Кристаллические структуры соединений типа кизерита. I. Кристаллические структуры Me (II) SO4*ЧАС2O (Me = Mn, Fe, Co, Ni, Zn) (английский перевод) ". Neues Jahrbuch für Mineralogie - Monatshefte: 296 – p306.CS1 maint: несколько имен: список авторов (связь)
- ^ Stadnicka, K .; Glazer, A.M .; Коралевски М. «Структура, абсолютная конфигурация и оптическая активность гексагидрата альфа-сульфата никеля» Acta Crystallographica, Раздел B: Структурная наука (1987) 43, p319-p325.
- ^ В. П. Тинг, П. Ф. Генри, М. Шмидтманн, К. К. Уилсон, М. Т. Веллер "Дифракция нейтронного порошка на месте и определение структуры при контролируемой влажности" Chem. Commun., 2009, 7527-7529. Дои:10.1039 / B918702B
- ^ Теппитак, Чатфорн; Чайнок, Киттипонг (2015). «Кристаллическая структура CdSO.4(ЧАС2O): Переопределение ». Acta Crystallographica E. 71 (10): i8-i9. Дои:10.1107 / S2056989015016904. PMID 26594423.CS1 maint: несколько имен: список авторов (связь)

