WikiDer > Хлорид родия (III)
 | |
 | |
 | |
| Имена | |
|---|---|
| Другие имена Трихлорид родия | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.138 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| RhCl3 | |
| Молярная масса | 209,26 г / моль |
| Внешность | темно-красное твердое вещество расплывающийся |
| Плотность | 5,38 г / см3, твердый |
| Температура плавления | ок. 450 ° С (842 ° F, 723 К) |
| Точка кипения | 717 ° С (1323 ° F, 990 К) |
| нерастворимый | |
| Растворимость | растворим в гидроксид и цианид растворы, также растворимые в царская водка |
| Кислотность (пKа) | кислая в растворе |
| −-7.5·10−6 см3/ моль | |
| Структура | |
| Моноклиника, mS16 | |
| С12 / м1, №12 | |
| восьмигранный | |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −234 кДж / моль |
| Опасности | |
| Паспорт безопасности | ICSC 0746 |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | > 500 мг / кг (крыса, перорально) 1302 мг / кг (крыса, перорально)[1] |
| Родственные соединения | |
Другой анионы | Фторид родия (III) Бромид родия (III) Иодид родия (III) |
Другой катионы | Хлорид кобальта (II) Хлорид иридия (III) |
Родственные соединения | Хлорид рутения (III) Хлорид палладия (II) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорид родия (III) относится к неорганические соединения с формулой RhCl3(ЧАС2O)п, куда п варьируется от 0 до 3. Это диамагнитные твердые тела с октаэдрическими центрами Rh (III). В зависимости от стоимости п, материал представляет собой плотное твердое вещество коричневого цвета или растворимую красноватую соль. Растворимая тригидратированная (n = 3) соль широко используется для получения соединений, используемых в гомогенный катализ, особенно для промышленного производства уксусная кислота и гидроформилирование.[2]
Структуры
Водные растворы RhCl3(ЧАС2O)3 были охарактеризованы 103Rh ЯМР-спектроскопия, который показывает наличие нескольких видов. Пропорции которых меняются со временем и зависят от концентрации хлорида. Относительное распределение этих видов определяет цвет растворов, который может варьироваться от желтого (ион гексаакво) до «малиново-красного». Некоторые из этих видов [Rh (H2O)6]3+, [RhCl (H2O)5]2+, СНГ- и транс- [RhCl2(ЧАС2O)4]+, и [RhCl3(ЧАС2O)3].[3] Отдельные ионы были разделены с помощью ионообменной хроматографии.[4]
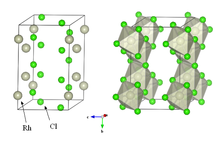
Безводный хлорид родия кристаллизуется в YCl3 и AlCl3 мотив (см. изображение вверху справа). Металлические центры октаэдрические, а галогениды - двухмостиковые.[5] Это плотное коричневое твердое вещество, нерастворимое в обычных растворителях и малоценное для лабораторных исследований.
Подготовка
RhCl3(ЧАС2O)3 производится из солей, таких как Na3RhCl6, причем последний получают при очистке родия от других металлы платиновой группы такие как платина и иридий. Натриевая соль превращается в H3RhCl6 к ионообменная хроматография. Перекристаллизация этой кислой соли из воды образует гидратированный трихлорид, иногда называемый «растворимым трихлоридом родия».[6] Безводный RhCl3 готовится по реакции хлор с родием губчатый металл при 200–300 ° С.[7] При температуре выше 800 ° C безводный хлорид превращается в металл Rh и хлор.[6]
Различные комплексы хлорида родия являются промежуточными продуктами очистки родия из его руд.[8]
Координационные комплексы
RhCl3(ЧАС2O)3 является предшественником самых разнообразных комплексы, некоторые из которых коммерчески полезны. Он реагирует с ацетилацетоном, давая ацетилацетонат родия.
Амины и пиридин
Растворы RhCl3(ЧАС2O)3 реагировать с аммиаком в присутствии спирта с образованием соли пентамминродий хлорид, [RhCl (NH3)5] Cl2. Цинк восстановление этого катиона с последующим добавлением сульфат дает бесцветный гидридный комплекс [HRh (NH3)5]ТАК4.[9]
При кипячении в смеси этанола и пиридин (py) гидратированный трихлорид родия превращается в транс- [RhCl2(ру)4)] Cl. В отсутствие восстановителя реакция дает фак- [RhCl3(ру)3], аналогичных производным тиоэфира.[5] Окисление водно-этанольного раствора пиридина и RhCl3(ЧАС2O)3 по воздуху дает синий парамагнитный кислородно-мостиковая смесь, [Cl (py)4Rh-O2-Rh (py)4Cl]5+.[10]
Тиоэфиры и третичные фосфины
Этанолик растворы гидратированного трихлорида родия реагируют с диалкилсульфиды.
- RhCl3(ЧАС2O)3 + 3 СР2 RhCl3(SR2)3 + 3 часа2О
Обе фак и мер стереоизомеры таких соединений были выделены.[5]
Реакция RhCl3(ЧАС2O)3 в мягких условиях с третичные фосфины дает аддукты, аналогичные вышеупомянутым тиоэфирным комплексам. Когда эти реакции проводятся в кипящем растворе этанола, происходит восстановление родия (III), что приводит к производным родия (I), таким как [RhCl (PPh3)3], Катализатор Уилкинсонапри окислении растворителя или, чаще, при избытке фосфина:[11][12]
- RhCl3(ЧАС2O)3 + 3 PPh3 + CH3CH2ОЙ RhCl (PPh3)3 + CH3CHO + 2 HCl + 3 H2О
- RhCl3(ЧАС2O)3 + 4 человека в час3 RhCl (PPh3)3 + OPPh3 + 2 HCl + 2 H2О
Алкены и окись углерода
Реакция RhCl3(ЧАС2O)3 с олефинами дает соединения типа Rh2Cl2(алкен)4. С 1,5-циклооктадиеном, RhCl3(ЧАС2O)3 реагировать в этаноле с образованием циклооктадиен димер хлорида родия.[13]

RhCl3(ЧАС2O)3 в метанол реагирует с монооксид углерода (1 бар) для получения H [RhCl2(CO)2], который содержит анион дикарбонилдихлоридородат (I); дальнейшее карбонилирование в присутствии цитрат натрия приводит к образованию тетрародий додекакарбонил, Rh4(CO)12, родий (0) кластерное соединение.[14] Обработка твердого RhCl3(ЧАС2O)3 с проточным CO дает димерный соединение родия (I)карбонилхлорид родия, [(CO)2Rh (μ-Cl)]2.[15]
Многочисленные Rh-CO-PR3 (R = органическая группа) соединения были получены в ходе обширных исследований на гидроформилирование катализ. RhCl (PPh3)3 реагирует с CO, давая транс-RhCl (CO) (PPh3)2, стехиометрически аналогичен, но менее реактивен, чем Васьковский комплекс. Транс-RhCl (CO) (PPh3)2 реагирует со смесью NaBH4 и PPh3 давать HRh (CO) (PPh3)3, высокоактивный катализатор гидроформилирования алкенов.[16]
При лечении с циклопентадиены или его производные, металлоорганический полусэндвич-компаунды могут быть произведены. Например, реакция тригидрата с пентаметилциклопентадиен (Cp * H) в горячем метаноле приводит к осаждению димер дихлорида пентаметилциклопентадиенил родия, [Cp * RhCl2]2:[17]
- 2 Cp * H + 2 RhCl3(ЧАС2O)3 [Cp * RhCl2]2 + 2 HCl + 6 H2О
Это соединение было впервые приготовлено из гексаметил Дьюара бензол и RhCl3(ЧАС2O)3.[18][19][20] Галогеноводородная кислота, необходимая для сжатия кольца перестановка генерируется на месте в метанольных растворах соли родия, и вторая стадия была проведена отдельно, что подтверждает это механистическое описание.[21] Реакция протекает с образованием 1,1-диметоксиэтан, CH3CH (OCH3)2, и гексаметилбензол производится побочная реакция.[20][21] Этот димер родия (III) может быть восстановлен с помощью цинк в присутствии CO с образованием комплекса родия (I) [Cp * Rh (CO)2].[22]
Катализ
Начиная с 1960-х годов, RhCl3(ЧАС2O)3 было показано, что он каталитически активен в различных реакциях с участием CO, H2, и алкены.[23] Например, RhCl3(ЧАС2O)3 был показан димериз этен к смеси СНГ и транс 2-бутен:
К сожалению, для высших алкенов эта реакция не проходит.
Было показано, что димеризация этилена включает катализ димерный соединение родия (I) [(η2-C2ЧАС4)2Rh (мк-Cl)2Rh (η2-C2ЧАС4)2]. Это и многие связанные с ним открытия взрастили тогда молодую область гомогенного катализа, в которой катализаторы растворены в среде с субстратом. До этой эры большинство металлических катализаторов были «гетерогенными», т.е. катализаторы были твердыми, а субстраты были жидкими или газами. Еще одним достижением в области гомогенного катализа было открытие, что PPh3-производные комплексы были активными каталитически, а также растворимы в органических растворителях,[16] наиболее известным таким катализатором является катализатор Уилкинсона, который катализирует гидрирование и изомеризация алкенов.[23] Гидроформилирование алкенов катализируется родственным RhH (CO) (PPh3)3. Катализ родием настолько эффективен, что он значительно вытеснил предыдущую технологию, основанную на менее дорогих кобальтовых катализаторах.
Безопасность
Хлорид родия (III) не включен в Приложение I к Директива 67/548 / EEC, но обычно классифицируется как вредный, R22: Вред при проглатывании. Некоторые соединения Rh были исследованы как противораковые препараты. Он указан в инвентаре Закон о контроле за токсичными веществами (TSCA).
Рекомендации
- ^ «Родий (пары металлов и нерастворимые соединения, как Rh)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Гринвуд, Н. И Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- ^ Карр, Кристофер; Глейзер, Юлиус; Сандстрём, Магнус (1987). "103Химические сдвиги Rh ЯМР всех десяти [RhClп(ОЙ2)6−п]3−п комплексы в водном растворе ». Неорг. Чим. Acta. 131 (2): 153–156. Дои:10.1016 / S0020-1693 (00) 96016-X.
- ^ Wolsey, Wayne C .; Reynolds, Charles A .; Клейнберг, Якоб (1963). «Комплексы в системе родий (III) -хлорид в кислотном растворе». Неорг. Chem. 2 (3): 463–468. Дои:10.1021 / ic50007a009.
- ^ а б c Коттон, Саймон А. (1997). Химия драгоценных металлов. Чепмен и Холл. ISBN 0-7514-0413-6.
- ^ а б Брауэр, Георг, изд. (1965). «Хлорид родия (III)». Справочник по препаративной неорганической химии. 2 (2-е изд.). Нью-Йорк: Академическая пресса. С. 1587–1588. ISBN 9780323161299.
- ^ Реннер, Германн; Шламп, Гюнтер; Кляйнвехтер, Инго; Дрост, Эрнст; Lüschow, Hans M .; Тьюс, Питер; Панстер, Питер; Диль, Манфред; Ланг, Ютта; Крейцер, Томас; Knödler, Alfons; Starz, Karl A .; Дерманн, Клаус; Ротхаут, Йозеф; Дризельманн, Ральф; Питер, Кэтрин; Шиле, Райнер (2005). «Металлы и соединения платиновой группы». Энциклопедия промышленной химии Ульмана. Вайнхайм: Вайли-ВЧ. Дои:10.1002 / 14356007.a21_075. ISBN 3527306730.
- ^ Benguerel, E .; Demopoulos, G.P .; Харрис, Г. Б. (1996). «Видообразование и разделение родия (III) из хлоридных растворов: критический обзор». Гидрометаллургия. 40 (1–2): 135–152. Дои:10.1016 / 0304-386X (94) 00086-I.
- ^ Осборн, Дж. А .; Thomas, K .; Уилкинсон, Г. (1972). Дихлорид пентаамминхлорродия (III) и сульфат пентааммингидридородия (III). Неорг. Synth. Неорганические синтезы. 13. С. 213–215. Дои:10.1002 / 9780470132449.ch43. ISBN 9780470132449.
- ^ Gillard, R.D .; Уилкинсон, Г. (1967). транс-Дихлортетра (пиридин) родиевые (III) соли. Неорг. Synth. Неорганические синтезы. 10. С. 64–67. Дои:10.1002 / 9780470132418.ch11. ISBN 9780470132418.
- ^ Осборн, Дж. А .; Jardine, F. H .; Янг, Дж. Ф .; Уилкинсон, Г. (1966). «Получение и свойства трис (трифенилфосфин) галогенородия (I) и некоторые его реакции, включая каталитическое гомогенное гидрирование олефинов и ацетиленов и их производных». J. Chem. Soc. А. 1966: 1711–1732. Дои:10.1039 / J19660001711.
- ^ Осборн, Дж. А .; Уилкинсон, Г. (1967). Трис (трифенилфосфин) галородий (I). Неорг. Synth. Неорганические синтезы. 10. С. 67–71. Дои:10.1002 / 9780470132418.ch12. ISBN 9780470132418.
- ^ Giordano, G .; Крэбтри, Р. Х. (1990). Ди-μ-хлор-бис (η4-1,5-циклооктадиен) диродий (I). Неорг. Synth. Неорганические синтезы. 28. С. 88–90. Дои:10.1002 / 9780470132500.ch50. ISBN 9780470132500.
- ^ Serp, P.H .; Kalck, P.H .; Feurer, R .; Моранчо, Р. (1998). Три (μ-карбонил) нонакарбонилтетрародий, Rh4(мк-СО)3(CO)4. Неорг. Synth. Неорганические синтезы. 32. С. 284–287. Дои:10.1002 / 9780470132630.ch45. ISBN 9780470132630.
- ^ МакКлеверти, Дж. А .; Уилкинсон, Г. (1966). Дихлортетракарбонилдиродий: (карбонилхлорид родия). Неорг. Synth. Неорганические синтезы. 8. С. 211–214. Дои:10.1002 / 9780470132395.ch56. ISBN 9780470132395.
- ^ а б Хартвиг, Джон Ф. (2010). Химия органопереходных металлов: от связывания к катализу. Нью-Йорк: Научные книги университета. ISBN 978-1-891389-53-5.
- ^ Белый, C .; Yates, A .; Майтлис, Питер М. (1992). (η5-Пентаметилциклопентадиенил) соединения родия и -иридия. Неорг. Synth. Неорганические синтезы. 29. С. 228–234. Дои:10.1002 / 9780470132609.ch53. ISBN 9780470132609.
- ^ Пакетт, Лео А.; Кроу, Грант Р. (1968). «Электрофильные добавки к гексаметилдеварбензолу». Tetrahedron Lett. 9 (17): 2139–2142. Дои:10.1016 / S0040-4039 (00) 89761-0.
- ^ Криджи, Рудольф; Грюнер, Х. (1968). «Катализируемые кислотой перегруппировки гексаметил-призмана и гексаметил-Дэвар-бензола». Энгью. Chem. Int. Эд. 7 (6): 467–468. Дои:10.1002 / anie.196804672.
- ^ а б Herrmann, Wolfgang A .; Зибилл, Кристиан (1996). "Бис {(μ-хлор) [хлор (η-пентаметилциклопентадиенил) родий]} - {Rh (μ-Cl) Cl [η-C5(CH3)5]}2". В Herrmann, Wolfgang A .; Зальцер, Альбрехт (ред.). Синтетические методы металлоорганической и неорганической химии - Том 1: Литература, лабораторные методы и общие исходные материалы. Георг Тиме Верлаг. С. 148–149. ISBN 9783131791610.
- ^ а б Черт возьми, Ричард Ф. (1974). «Реакции диентриенов и тетраенов с соединениями переходных металлов». Химия органопереходных металлов: механистический подход. Академическая пресса. С. 116–117. ISBN 9780323154703.
- ^ Herrmann, Wolfgang A .; Зибилл, Кристиан (1996). «Дикарбонил (η-пентаметилциклопентадиенил) родий - Rh [η-C5(CH3)5] (CO)2". В Herrmann, Wolfgang A .; Salzer, Albrecht (ред.). Синтетические методы металлоорганической и неорганической химии - Том 1: Литература, лабораторные методы и общие исходные материалы. Георг Тиме Верлаг. С. 147–148. ISBN 9783131791610.
- ^ а б Беннетт, Мартин А.; Лонгстафф, П. А. (1965). «Комплексы родия (I) с трифенилфосфином». Chem. Ind. (Лондон): 846.
внешняя ссылка
| Викискладе есть медиафайлы по теме Хлорид родия (III). |
![{ displaystyle { ce {-> [{ ce {CH3CH2OH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a6552044024d3bcd2e07972f7ae82ca8ca646a1)
![{ displaystyle { ce {-> [{ ce {CH3CH2OH}} { text {/ Δ}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12a08389489aa7ab9fbd60f946daba3c1a06e582)
![{ displaystyle { ce {-> [{ ce {CH3OH}} { text {/ Δ}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b38287ac05102ae2efa8432ce004a22c2dc924e)
![Синтез димера родия (III) [Cp * RhCl2] 2 из гексаметилового бензола Дьюара.](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/Hexamethyl_Dewar_benzene_reacting_with_rhodium_chloride_under_acidic_conditions.PNG/700px-Hexamethyl_Dewar_benzene_reacting_with_rhodium_chloride_under_acidic_conditions.PNG)
![{ Displaystyle { ce {-> [{ ce {RhCl3 (H2O) 3}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb2c131af4d6b9deaacb2b34406a3bdff68a87cb)