WikiDer > Америций (III) хлорид
 | |
| Имена | |
|---|---|
| Название ИЮПАК Америций (III) хлорид | |
| Систематическое название ИЮПАК Америций (3+) хлорид | |
| Другие имена Америция хлорид Трихлорид америция | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| AmCl3 | |
| Молярная масса | 349 г · моль−1 |
| Внешность | Светло-красные непрозрачные кристаллы |
| Плотность | 5,87 г см−3[1] |
| Температура плавления | 715 ° С (1319 ° F, 988 К)[2] |
| Точка кипения | 850 ° С (1560 ° F, 1120 К)[1] |
| Структура | |
| шестиугольник (UCl3 тип), hP8 | |
| P63/ м, № 176 | |
| Трехгранный треугольный призматический (девятикоординатный) | |
| Родственные соединения | |
Другой катионы | Хлорид европия (III) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
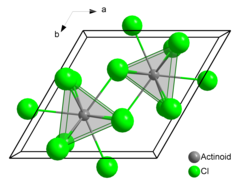
Америций (III) хлорид или трихлорид америция это химическое соединение состоит из америций и хлор с формула AmCl3. Образует розовый шестиугольник кристаллы. В твердом состоянии каждый атом америция имеет девять атомов хлора в качестве ближайших соседей, примерно на одинаковом расстоянии, в треугольной тригональной призматической конфигурации.[3][4]
Гексагидрат имеет моноклинную кристаллическую структуру с: a = 970,2 мкм, b = 656,7 мкм и c = 800,9 мкм; β = 93 ° 37 '; космическая группа: п2/п.[5]
Реакции
Хлорид америция (III) электрорафинирование метод был исследован для разделения смесей актиниды, поскольку стандартная свободная энергия Гиббса образования хлорида америция (III) сильно отличается от остальных хлоридов актинида.[6]Это можно использовать для удаления америция из плутоний путем плавления сырой смеси вместе с солями, такими как хлорид натрия.[7]
использованная литература
- ^ а б «Химия: Периодическая таблица: америций: данные соединения (хлорид америция (III))». WebElements. Получено 2008-06-24.
- ^ Perry, Dale L .; Филлипс, Сидни Л. (1995), Справочник неорганических соединений, CRC Press, стр. 15, ISBN 0-8493-8671-3, получено 2008-06-25
- ^ Л. Б. Аспри, Т. К. Кинан, Ф. Х. Круз: «Кристаллические структуры трифторидов, трихлоридов, трибромидов и трийодидов америция и кюрия», Неорг. Chem. 1965, 4 (7), 985–986; Дои:10.1021 / ic50029a013.
- ^ А. Ф. Уэллс: Структурная неорганическая химия 5-е издание (1984 г.) Oxford Science Publications, ISBN 0-19-855370-6.
- ^ Джон Х. Бернс, Джозеф Ричард Петерсон: "Кристаллические структуры гексагидрата трихлорида америция и гексагидрата трихлорида берклия", Неорг. Chem. 1971, 10 (1), 147–151; Дои:10.1021 / ic50095a029.
- ^ Агентство по ядерной энергии (2001 г.), Материалы семинара по пирохимическим разделениям., Авиньон, Франция: Издательство ОЭСР, стр. 276–277, ISBN 92-64-18443-0, получено 2008-06-24
- ^ Переработка плутония в комплексе ядерного оружия, Дайан Паблишинг, 1992, стр. 21, ISBN 1-56806-568-X, получено 2008-06-24
| Эта неорганический соединение–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |