WikiDer > Пентафторид хлора
 | |||
| Идентификаторы | |||
|---|---|---|---|
3D модель (JSmol) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.033.734 | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| ClF5 | |||
| Молярная масса | 130,445 г моль−1 | ||
| Внешность | бесцветный газ | ||
| Плотность | 4,5 кг / м3 (г / л) | ||
| Температура плавления | -103 ° С (-153 ° F, 170 К) | ||
| Точка кипения | -13,1 ° С (8,4 ° F, 260,0 К) | ||
| Гидролизует | |||
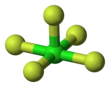
| Структура | |||
| Квадрат пирамидальный | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 310,73 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −238,49 кДж моль−1 | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Пентафторид хлора является межгалогенное соединение с формулой ClF5. Этот бесцветный газ является сильным окислителем, который когда-то был кандидатом в окислитель ракет. Молекула принимает квадратная пирамидальная структура с C4в симметрия,[1] что подтверждается его высокое разрешение 19F ЯМР спектр.[2]
Подготовка
Некоторые из самых ранних исследований препарата были засекречены.[3][4] Впервые он был подготовлен фторирование из трифторид хлора при высоких температурах и высоких давлениях:[3]
- ClF3 + F2 → ClF5
- ClF + 2F2 → ClF5
- Cl2 + 5F2 → 2ClF5
- CsClF4 + F2 → CsF + ClF5
NiF2 катализирует эту реакцию.[5]
Фториды некоторых металлов, MClF4 (т.е. KClF4, RbClF4, CsClF4), реагируют с F2 производить ClF5 и соответствующий фторид щелочного металла.[4]
Реакции
В сильно экзотермической реакции ClF5 реагирует с водой с образованием хлорфторид и фтороводород:[6]
- ClF
5 + 2 ЧАС
2О → ClO
2F + 4 HF
Это также сильный фторирующий агент. При комнатной температуре он легко вступает в реакцию со всеми элементами (включая «инертные» элементы, такие как платина и золото) Кроме благородные газы, азот, кислород и фтор.[2]
Смотрите также
Рекомендации
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 833. ISBN 978-0-08-037941-8.
- ^ а б Пилипович, Д .; Maya, W .; Lawton, E.A .; Bauer, H.F .; Sheehan, D. F .; Ogimachi, N.N .; Wilson, R.D .; Gunderloy, F.C .; Бедвелл, В. Э. (1967). «Пентафторид хлора. Получение и свойства». Неорганическая химия. 6 (10): 1918. Дои:10.1021 / ic50056a036.
- ^ а б Кларк, Джон Д. (1972). Зажигание! Неофициальная история жидкого ракетного топлива (PDF). Издательство Университета Рутгерса. С. 87–88. ISBN 0-8135-0725-1.
- ^ а б Смит Д. Ф. (1963). «Пентафторид хлора». Наука. 141 (3585): 1039–1040. Дои:10.1126 / science.141.3585.1039. PMID 17739492.
- ^ Šmalc A, emva B, Slivnik J, Lutar K (1981). «О синтезе пентафторида хлора». Журнал химии фтора. 17 (4): 381–383. Дои:10.1016 / S0022-1139 (00) 81783-2.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 834. ISBN 978-0-08-037941-8.