WikiDer > Трихлорид галлия
 | |
| Имена | |
|---|---|
| Другие имена Хлорид галлия (III), трихлорогаллий, трихлорогаллан | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.033.268 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| Характеристики | |
| GaCl 3 | |
| Молярная масса | 176,073 г / моль |
| Внешность | бесцветные кристаллы расплывающийся |
| Плотность | 2,47 г / см3 2,053 г / см3 при температуре плавления |
| Температура плавления | 77,9 ° С (172,2 ° F, 351,0 К) (безводный) 44,4 ° C (гидрат) |
| Точка кипения | 201 ° С (394 ° F, 474 К) |
| очень растворимый | |
| Растворимость | растворим в бензол, CCl4, CS2 |
| −63.0·10−6 см3/ моль | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 4700 мг / кг (крыса, перорально) |
| Родственные соединения | |
Другой анионы | Фторид галлия (III) Бромид галлия (III) Иодид галлия (III) |
Другой катионы | Хлорид алюминия Хлорид индия (III) Хлорид таллия (III) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Трихлорид галлия это химическое соединение с формулой GaCl3. Твердый трихлорид галлия существует в виде димера с формулой Ga2Cl6.[1] Он бесцветен и растворим практически во всех растворителях, даже в алканах, что действительно необычно для галогенида металла. Это основной предшественник большинства производных галлий и реагент в органический синтез.[2]
Как Кислота Льюиса, GaCl3 мягче, чем трихлорид алюминия. Галлий (III) восстановить легче, чем Al (III), поэтому химия восстановленных соединений галлия более обширна, чем для алюминия. Ga2Cl4 известно, тогда как соответствующий Al2Cl4 не является. Координационная химия Ga (III) и Fe (III) схожа, а соединения галлия (III) использовались в качестве диамагнитных аналогов соединений трехвалентного железа.
Подготовка
Трихлорид галлия можно получить из элементов, нагревающих галлий металл в потоке хлор, и очистка продукта сублимацией в вакууме.[3][4]
- 2 Ga + 3 Cl2 → 2 GaCl3
Его также можно приготовить путем нагревания оксид галлия с тионилхлорид:[5]
- Ga2О3 + 3 SOCl2 → 2 GaCl3 + 3 СО2
Металлический галлий медленно реагирует с соляной кислотой. Эта реакция производит водород газ медленно.
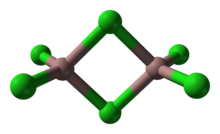
Структура
В качестве твердого вещества он имеет битетраэдрическую структуру с двумя мостиковыми хлоридами. Его структура напоминает структуру трибромид алюминия. В отличие AlCl3 и InCl3 Элемент содержит 6 координатных металлических центров. Как следствие его молекулярной природы и связанной с этим низкой энергия решетки, трихлорид галлия имеет более низкую температуру плавления по сравнению с тригалогенидами алюминия и индия. Формула Ga2Cl6 часто пишется как Ga2(мк-Cl)2Cl4. В газовой фазе димеры диссоциируют на тригонально плоский мономеры.
Комплексы
Галлий - самый легкий член Группы 13, имеющий полное d оболочка, (галлий имеет электронную конфигурацию [Ar] 3d10 4s2 4п1) ниже валентных электронов, которые могли бы участвовать в d-π-связывание с лигандами. Низкая степень окисления Ga в Ga (III) Cl3, наряду с низким электроотрицательность и высокий поляризуемость, позвольте GaCl3 вести себя как «мягкая кислота» с точки зрения Теория HSAB. Прочность связей между галогенидами галлия и лигандами широко изучалась. Что появляется:
- GaCl3 слабее Кислота Льюиса чем AlCl3 по отношению к донорам N и O, например пиридин
- GaCl3 сильнее Кислота Льюиса чем AlCl3 к тиоэфиры например диметилсульфид, Мне2S
С ионом хлорида в качестве лиганда тетраэдрический GaCl4− образуется 6-координатный GaCl63− не может быть сделано. Соединения типа KGa2Cl7 у которых есть хлорид мостовой анионы известны.[6]В расплавленной смеси KCl и GaCl3, существует следующее равновесие:
- 2 GaCl4− ⇌ Ga2Cl7− + Cl−
Использует
Органический синтез
Трихлорид галлия - это Катализатор кислоты Льюиса, например, в Реакция Фриделя – Крафтса, а также используется в реакции карбогаллирования соединений с тройной углерод-углеродной связью. Это предшественник галлийорганические реагенты.[2]
Обнаружение солнечных нейтрино
110 тонн водного раствора трихлорида галлия было использовано в ГАЛЛЕКС и GNO эксперименты, проведенные на Laboratori Nazionali del Gran Sasso в Италии для обнаружения солнечные нейтрино. В этих экспериментах германий-71 был произведен нейтринными взаимодействиями с изотопом галлий-71 (который имеет естественное содержание 40%), и были измерены последующие бета-распады германия-71.[7]
Смотрите также
Рекомендации
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- «Галлий». Периодическая таблица WebElements.
- ^ Уэллс, А.Ф. (1984) Структурная неорганическая химия, Оксфорд: Clarendon Press. ISBN 0-19-855370-6.
- ^ а б Ямагути, Масахико; Мацунага, Сигеки; Шибасаки, Масакацу; Мишле, Бастьен; Бур, Кристоф; Гандон, Винсент (2014), «Трихлорид галлия», Энциклопедия реагентов для органического синтеза, John Wiley & Sons, Ltd, стр. 1–8, Дои:10.1002 / 047084289x.rn00118u.pub3, ISBN 9780470842898
- ^ С. С. Уоллворк И. Дж. Уоррал Дж. Хим. Soc 1965,1816
- ^ Ковар, Р. А. Неорганические синтезы "трихлорида галлия", 1977, том XVII, стр. 167-172. ISBN 0-07-044327-0
- ^ H.Hecht, G.Jander, H.Schlapmann, Z. Anorg. Allgem. Chem. Т.254, с.255 (1947)
- ^ Дж. Х. фон Барнер Inorg Chem 1985 24 1686
- ^ Дэвид Р. Лид, изд. Справочник по химии и физике, 85-е издание, Интернет-версия 2005. CRC Press, 2005.
внешняя ссылка
- «Руководство по оказанию первой неотложной помощи - трихлорид галлия». Агентство по охране окружающей среды США. Архивировано из оригинал на 2004-11-12.
