WikiDer > Хлорид урана (III)
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид урана (III) | |
| Другие имена Хлорид урана Трихлорид урана Гипоурановый хлорид | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Свойства | |
| Cl3U | |
| Молярная масса | 344.38 г · моль−1 |
| Внешность | Зеленое кристаллическое твердое вещество |
| Плотность | 5.500 г / см3, жидкость |
| Температура плавления | 837 ° С (1539 ° F, 1110 К) |
| Точка кипения | 1,657 ° С (3015 ° F, 1930 К) |
| Растворимый | |
| Структура | |
| Гибридизация | Трехгранный треугольный призматический |
| Опасности | |
| точка возгорания | Не воспламеняется |
| Не воспламеняется | |
| Родственные соединения | |
Родственные соединения | Хлорид урана (IV), Хлорид урана (V), Хлорид урана (VI) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорид урана (III), UCl3, это химическое соединение который содержит земляной металл уран и хлор. UCl3 в основном используется для переработки отработавшего ядерного топлива. Хлорид урана (III) синтезируется различными способами из хлорид урана (IV); однако UCl3 менее стабилен, чем UCl4.
Подготовка
Есть два способа синтезировать хлорид урана (III). Следующие процессы описывают, как производить хлорид урана (III).
(1) В смесь NaCl-KCl при 670–710 ° C добавьте тетрахлорид урана с металлическим ураном.
(2) Нагрейте хлорид урана (IV) в газообразном водороде.
Свойства
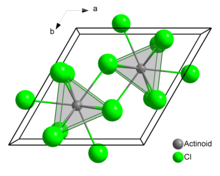
В твердом хлориде урана (III) каждый атом урана имеет девять атомов хлора в качестве ближайших соседей, примерно на одинаковом расстоянии, в треугольной призматической конфигурации с треугольными головками.[3]
Хлорид урана (III) представляет собой зеленое кристаллическое твердое вещество при комнатной температуре. UCl3 плавится при 837 ° C и кипит при 1657 ° C. Хлорид урана (III) имеет плотность 5500 кг / м3.3 или 5.500 г / см3.
Его весовой состав:
- Хлор: 30,84%
- Уран: 69,16%
Его формальные окислительные состояния:
- Хлор: -1
- Уран: +3
Хлорид урана (III) хорошо растворяется в воде, а также очень гигроскопичный. UCl3 более устойчив в растворе соляная кислота.[4]
Использует
Реагент
Хлорид урана (III) используется в реакциях с тетрагидрофуран (THF) и метилциклопентадиен натрия для получения различных урановых металлоцен комплексы.[5]
Катализатор
Хлорид урана (III) используется в качестве катализатора во время реакций между литийалюминийгидрид (LiAlH4) и олефины для производства алкилалюминатных соединений.[6]
Расплавленная форма
Расплавленная форма хлорида урана (III) представляет собой типичное соединение в пирохимических процессах, так как оно важно при переработке отработавшего ядерного топлива.[7] UCl3 обычно представляет собой форму, которую уран принимает в качестве отработавшего топлива в процессах электроочистки.[7][8]
Увлажняет
Существует три гидрата хлорида урана (III):
- UCl3.2H2О.2CH3CN
- UCl3.6H2О
- UCl3.7H2О
Каждый из них синтезируется восстановлением хлорид урана (IV) в метилцианиде (ацетонитрил), с определенным количеством воды и пропионовая кислота.[9]
Меры предосторожности
Пока нет долгосрочных данных о токсическом воздействии UCl.3, важно по возможности минимизировать воздействие этого соединения.
Подобно другим растворимым соединениям урана, UCl3 вероятно, всасывается в кровь через альвеолярные карманы легких в течение нескольких дней после воздействия. Воздействие хлорида урана (III) приводит к токсичность почечной системы.[10]
| Викискладе есть медиафайлы по теме хлорид урана (III). |
использованная литература
- ^ Серрано, К .; Taxil, P .; Dugne, O .; Буве, С .; Puech, E. J. Nucl. Mater. 2000, 282, 137–145.
- ^ Ремсен, Ира. Неорганическая химия. Нью-Йорк: Генри Холт и компания, 1890.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Коми, Артур М .; Хан, Дороти А. Словарь химических растворимостей: неорганические. Нью-Йорк: Компания MacMillan, 1921.
- ^ Brenna, J.G .; Anderson, R.A .; Залкин, А. Неорг. Chem. 1986, 25, 1756–1760.
- ^ Le Marechal, J.F .; Эфритихин, М .; Folcher, G. J. Organomet. Chem. 1986, 309, C1 – C3.
- ^ а б Окамото, Й .; Madden, P .; Минато, К. Дж. Nucl. Mater. 2005, 344, 109–114.
- ^ Окамото, Й .; Кобаяши, Ф .; Огава, Т. Дж. Сплавы Compd. 1998, 271, 355–358.
- ^ Mech, A .; Karbowick, M .; Лис, Т. Многогранник. 2006, 25, 2083–2092.
- ^ Бертелл, Розали. «Ветераны войны в Персидском заливе и обедненный уран». Май 1999 г. В наличии: http://ccnr.org/du_hague.html
внешние ссылки
- Информация о хлориде урана (III) в Webelements
- Хлорид урана (III) International Bio-Analytical Industries, Inc.
- Обедненный уран: на все вопросы о DU и синдроме войны в Персидском заливе еще нет ответа