WikiDer > Триоксид урана
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Триоксид урана Оксид урана (VI) | |
| Другие имена Оксид уранила Оксид урана | |
| Идентификаторы | |
| ECHA InfoCard | 100.014.274 |
| UNII | |
| Характеристики | |
| UO3 | |
| Молярная масса | 286,29 г / моль |
| Внешность | желто-оранжевый порошок |
| Плотность | 5,5–8,7 г / см3 |
| Температура плавления | ~ 200–650 ° C (разлагается) |
| Частично растворим | |
| Структура | |
| см текст | |
| я41/ amd (γ-UO3) | |
| Термохимия | |
Стандартный моляр энтропия (S | 99 Дж · моль−1· K−1[1] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −1230 кДж · моль−1[1] |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
Классификация ЕС (DSD) (устарело) | Очень токсичен (Т +) Опасно для окружающей среды (N) |
| R-фразы (устарело) | R26 / 28, R33, R51 / 53 |
| S-фразы (устарело) | (S1 / 2), S20 / 21, S45, S61 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
| Диоксид урана Окись триурана | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
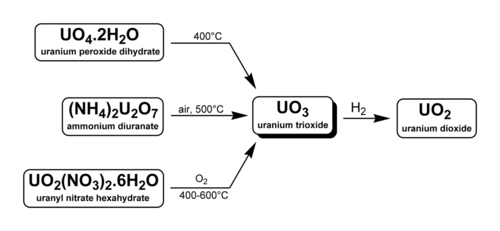
Триоксид урана (UO3), также называемый уранил окись, оксид урана (VI), и оксид урана, - шестивалентный окись из уран. Твердое вещество можно получить путем нагревания уранилнитрат до 400 ° C. Наиболее часто встречается полиморф, γ-UO3, представляет собой желто-оранжевый порошок.
Производство и использование
Есть три метода получения триоксида урана. Как указано ниже, два из них используются в промышленности при переработке ядерного топлива и обогащении урана.
- U3О8 может быть окислен кислородом при 500 ° C.[2] Обратите внимание, что выше 750 ° C даже при 5 атм.2 UO3 разлагается на U3О8.[3]
- Уранилнитрат, UO2(НЕТ3)2· 6H2O можно нагреть, чтобы получить UO3. Это происходит во время переработка ядерного топлива. Топливные стержни растворены в HNO3 разделять уранилнитрат из плутоний и продукты деления ( PUREX метод). Чистый нитрат уранила превращается в твердый UO3 нагреванием до 400 ° C. После восстановления водородом (при наличии другого инертного газа) до диоксид урана, уран можно использовать в новых МОКС-топливо стержни.
- Диуранат аммония или же диуранат натрия (Na2U2О7· 6H2O) может быть разложен. Диуранат натрия, также известный как желтый пирог, превращается в триоксид урана в обогащение урана. Диоксид урана и тетрафторид урана являются промежуточными звеньями в процессе, который заканчивается гексафторид урана.[4]
Триоксид урана транспортируется между перерабатывающими предприятиями в виде геля, чаще всего из шахты на перерабатывающие заводы. При использовании для конверсии все оксиды урана часто называют переработанный уран(RepU).[5]
Cameco Corporation, который работает на крупнейшем в мире урановом заводе по адресу Слепая река, Онтарио, производит триоксид урана высокой чистоты.
Сообщалось, что коррозия урана в водном растворе, богатом кремнеземом, образует диоксид урана, триоксид урана,[6] и гроб.[7] В чистой воде, шепит (UO2)8О2(ОЙ)12· 12 (H2O) образуется[8] в первую неделю, а затем через четыре месяца студтит (UO2) O2· 4 (H2O) был произведен. Это изменение оксида урана также приводит к образованию метастудтит,[9][10] более стабильный пероксид уранила, часто обнаруживаемый на поверхности отработавшего ядерного топлива, контактирующего с водой. Отчеты о коррозии металлического урана были опубликованы Королевское общество.[11][12]
Опасности для здоровья и безопасности
Как и все соединения шестивалентного урана, UO3 опасен при вдыхании, проглатывании и при контакте с кожей. Это ядовитое слаборадиоактивное вещество, которое может вызывать одышку, кашель, острые поражения артерий и изменения хромосом белые кровяные клетки и гонады ведущий к врожденные пороки развития при вдыхании.[13][14] Однако после попадания внутрь уран в основном токсичен для почки и может серьезно повлиять на их функцию.
Структура
Твердотельная структура
Единственный хорошо охарактеризованный бинарный триоксид любого актинид UO3, из которых несколько полиморфы известны. Solid UO3 проигрывает O2 при нагревании дать зеленый цвет U3О8: отчеты о температуре разложения на воздухе варьируются от 200–650 ° C. Нагрев при 700 ° C под H2 дает темно-коричневый диоксид урана (UO2), который используется в MOX ядерное топливо стержни.
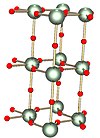
Альфа
| Форма α (альфа): слоистое твердое тело, в котором двухмерные слои связаны атомами кислорода (показаны красным) | Гидратированный пероксид уранила, образованный добавлением пероксид водорода к водному раствору уранилнитрат при нагревании до 200–225 ° C образует аморфный триоксид урана, который при нагревании до 400–450 ° C образует триоксид альфа-урана.[3] Было заявлено, что присутствие нитрата снижает температуру, при которой экзотермический изменение от аморфный форма в альфа-форму происходит.[15] |
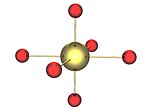
Бета
| β (бета) UO3. Это твердое тело имеет структуру, которая опровергает большинство попыток его описать. | Эта форма может быть образована при нагревании диураната аммония, в то время как P.C. Дебец и Б. Loopstra обнаружил четыре твердые фазы в UO3-ЧАС2O-NH3 система, которую все они могли рассматривать как UO2(ОЙ)2.ЧАС2O, где часть воды была заменена аммиаком.[16][17] Независимо от точной стехиометрии или структуры, было обнаружено, что прокаливание при 500 ° C на воздухе образует бета-форму триоксида урана.[3] |
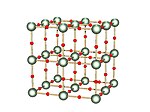
Гамма
| Форма γ (гамма) с различными урановыми средами, выделенными зеленым и желтым цветом. | Наиболее часто встречающийся полиморф - это γ-UO.3, чей рентгеновская структура была решена из данных порошковой дифракции. Соединение кристаллизуется в космической группе I41/ драм с двумя атомами урана в асимметричной единице. Оба окружены несколько искаженными октаэдрами атомов кислорода. Один атом урана имеет два более близких и четыре более удаленных атома кислорода, тогда как другой имеет четыре близких и два более удаленных атома кислорода в качестве соседей. Таким образом, описание структуры как [UO2]2+[UO4]2− , то есть уранил уранат.[18] |
| Окружение атомов урана показано желтым в гамма-форме | Цепочки U2О2 Кольца в гамме образуют слои, чередующиеся слои, расположенные под углом 90 градусов друг к другу. Эти цепочки показаны как содержащие желтые атомы урана в октаэдрическом окружении, которые искажены в сторону плоской квадратной формы из-за удлинения осевой кислород-уран облигации. |
Дельта
| Форма дельта (δ) - это кубический твердое тело, в котором атомы кислорода расположены между атомами урана.[19] |
Форма высокого давления
Существует твердая форма высокого давления с U2О2 и ты3О3 звенит в нем.[20][21]
Увлажняет
Несколько гидраты триоксида урана известны, например, UO3· 6H2О.[3]
Параметры валентности связи
Это возможно валентность облигации расчеты[22] чтобы оценить, насколько велик вклад данного атома кислорода в предполагаемую валентность урана.[23] В расчетах валентности связи используются параметры, которые оцениваются после изучения большого количества кристаллических структур оксидов урана (и родственных соединений урана), обратите внимание, что степени окисления, которые обеспечивает этот метод, являются только руководством, которое помогает в понимании кристаллической структуры.
Используемая формула:
Сумма s значение равно степени окисления металлического центра.
Для связывания урана с кислородом константы RО и B приведены в таблице ниже. Для каждой степени окисления используйте параметры из приведенной ниже таблицы.
| Состояние окисления | рО | B |
|---|---|---|
| U (VI) | 2,08 Å | 0.35 |
| U (V) | 2,10 Å | 0.35 |
| U (IV) | 2,13 Å | 0.35 |
Эти расчеты можно производить на бумаге или в программном обеспечении.[24][25]
Молекулярные формы
Хотя триоксид урана встречается в виде твердого полимера в условиях окружающей среды, определенная работа была проделана в отношении молекулярной формы в газовой фазе, в исследованиях изоляции матриц и в расчетах.
Газовая фаза
При повышенных температурах газообразный UO3 в равновесие с твердым U3О8 и молекулярный кислород.
- 2 U3О8(s) + O2(г) ⇌ 6 UO3(грамм)
С повышением температуры равновесие смещается вправо. Эта система была исследована при температурах от 900 ° C до 2500 ° C. Давление паров мономерного UO3 в равновесии с воздухом и твердым U3О8 при атмосферном давлении около 10−5 мбар (1 мПа) при 980 ° C, повышение до 0,1 мбар (10 Па) при 1400 ° C, 0,34 мбар (34 Па) при 2100 ° C, 1,9 мбар (193 Па) при 2300 ° C и 8,1 мбар (809 Па) при 2500 ° С.[26][27]
Матричная изоляция
Инфракрасная спектроскопия молекулярного UO3 изолированный в матрице аргона указывает на Т-образную структуру (точечная группа C2v) для молекулы. Это в отличие от обычно встречающихся D3ч молекулярная симметрия представлен большинством триоксидов. Из силовых констант авторы рассчитывают, что длина связи U-O составляет от 1,76 до 1,79. Å (176–179 вечера).[28]
Вычислительное исследование
Расчеты показывают, что точечная группа молекулярного UO3 является C2vс длиной аксиальной связи 1,75 Å, экваториальной длиной связи 1,83 Å и углом между осевыми атомами кислорода 161 °. Более симметричный D3ч является седловой точкой, на 49 кДж / моль выше C2v минимум. Авторы ссылаются на второй порядок Эффект Яна – Теллера как объяснение.[29]
Кубическая форма триоксида урана
Кристаллическая структура фазы триоксида урана состава UO2·82 был определен методами дифракции рентгеновских лучей на порошке с использованием фокусирующей камеры типа Guinier. Элементарная ячейка кубическая с a = 4 · 138 ± 0 · 005 kX. Атом урана расположен в (000), а атомы кислорода в (просмотреть исходный код MathML), (просмотреть исходный код MathML) и (просмотреть исходный код MathML) с некоторыми анионными вакансиями. Соединение изоструктурно ReO3. Расстояние связи U-O 2 · 073 Å согласуется с предсказанным Захариасеном для прочности связи S = 1.[30]
Реактивность
Триоксид урана реагирует при 400 ° C с фреон-12 формировать хлор, фосген, углекислый газ и тетрафторид урана. Фреон-12 можно заменить на фреон-11 который формирует четыреххлористый углерод вместо углекислого газа. Это случай жесткого пергалогенированного фреон который обычно считается инертным при химическом превращении при умеренной температуре.[31]
- 2 CF2Cl2 + UO3 → УФ4 + CO2 + COCl2 + Cl2
- 4 CFCl3 + UO3 → УФ4 + 3 COCl2 + CCl4 + Cl2
Триоксид урана можно растворить в смеси трибутилфосфат и теноилтрифторацетон в сверхкритический диоксид углерода, во время растворения использовали ультразвук.[32]
Электрохимическая модификация
Обратимая вставка магний катионы в решетка триоксида урана циклическая вольтамперометрия используя графит исследован электрод, модифицированный микроскопическими частицами оксида урана. Этот эксперимент также был проведен для U3О8. Это пример электрохимия твердого модифицированного электрод, эксперимент, который был проведен для триоксида урана, относится к электрод из углеродной пасты эксперимент. Также возможно восстановление триоксида урана с помощью натрий металл с образованием оксидов натрия урана.[33]
Было так, что можно вставить литий[34][35][36] в решетку триоксида урана электрохимическими средствами, это похоже на то, как некоторые перезаряжаемый литий-ионные батареи работай. В этих перезаряжаемых элементах один из электродов представляет собой оксид металла, который содержит металл, такой как кобальт который может быть уменьшен, чтобы поддерживать электронейтральность для каждого электрона, который добавляется к материалу электрода, ион лития входит в решетку этого оксидного электрода.
Оксид урана амфотерный и реагирует как кислота и как основание, в зависимости от условий.
- Как кислота
- UO3 + H2O → UO2−
4 + 2 часа+
Растворение оксида урана в сильном основание подобно едкий натр образует дважды отрицательно заряженный уранат анион (UO2−
4). Уранаты имеют тенденцию соединяться, образуя диуранат, U
2О2−
7, или другие полиуранаты. Важные диуранаты включают диуранат аммония ((NH4)2U2О7), диуранат натрия (Na2U2О7) идиуранат магния (MgU2О7), которая является частью некоторых желтые пироги. Стоит отметить, что уранаты вида M2UO4 делать нет содержать UO2−
4 ионов, а уплощенный UO6 октаэдры, содержащие уранильную группу и мостиковые атомы кислорода.[37]
- В качестве базы
- UO3 + H2O → UO2+
2 + 2 ОН−
Растворение оксида урана в сильной кислоте, например серный или же азотная кислота образует двойной положительно заряженный уранил катион. В уранилнитрат сформирован (UO2(НЕТ3)2· 6H2O) растворим в эфиры, спирты, кетоны и сложные эфиры; Например, трибутилфосфат. Эта растворимость используется для отделения урана от других элементов в ядерная переработка, который начинается с растворения ядерное топливо стержни в азотная кислота. В уранилнитрат затем превращается в триоксид урана при нагревании.
Из азотная кислота можно получить уранилнитрат, транс-UO2(НЕТ3)2· 2H2O, состоящий из восьмикоординированного урана с двумя двузубый нитрато-лиганды и два водных лиганда, а также знакомое ядро O = U = O.
Оксиды урана в керамике
UO3керамика становится зеленой или черной при обжиге в восстановительной атмосфере и от желтой до оранжевой при обжиге в кислороде. Оранжевого цвета Fiestaware хорошо известный пример продукта с глазурью на основе урана. UO3-Также использовался в составах эмаль, урановое стекло, и фарфор.
До 1960 г. UO3 использовался как агент кристаллизации в цветных кристаллических глазури. Можно определить с помощью счетчик Гейгера если глазурь или стекло из УО3.
Рекомендации
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A23. ISBN 978-0-618-94690-7.
- ^ Шефт I, Фрид S, Дэвидсон N (1950). «Получение триоксида урана». Журнал Американского химического общества. 72 (5): 2172–2173. Дои:10.1021 / ja01161a082.
- ^ а б c d Уиллер VJ, Dell RM, Wait E (1964). «Триоксид урана и UO3 гидраты ». Журнал неорганической и ядерной химии. 26 (11): 1829–1845. Дои:10.1016/0022-1902(64)80007-5.
- ^ Делл Р.М., Уиллер VJ (1962). «Химическая реакционная способность триоксида урана, часть 1. - Конверсия в уран.3О8, UO2 и УФ4". Труды общества Фарадея. 58: 1590–1607. Дои:10.1039 / TF9625801590.
- ^ «Транспортировка радиоактивных материалов - Всемирная ядерная ассоциация». www.world-nuclear.org. Получено 12 апреля 2018.
- ^ Trueman ER, Black S, Read D, Hodson ME (2003) "Изменение металлического обедненного урана" Тезисы докладов конференции Гольдшмидта, п. A493 Абстрактные
- ^ Гуо X., Szenknect S., Mesbah A., Labs S., Clavier N., Poinssot C., Ushakov S.V., Curtius H., Bosbach D., Rodney R.C., Burns P. and Navrotsky A. (2015). «Термодинамика образования коффинита, USiO4». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 112 (21): 6551–6555. Дои:10.1073 / pnas.1507441112. ЧВК 4450415. PMID 25964321.CS1 maint: несколько имен: список авторов (связь)
- ^ Schoepite. Webmineral.com. Проверено 19 июля 2011.
- ^ Weck P. F .; Kim E .; Джов-Колон К. Ф. и Сассани Д. К. (2012). «Структуры гидратов пероксида уранила: изучение первых принципов студтита и метастудтита». Дальтон Транс. 111 (41): 9748–52. Дои:10.1039 / C2DT31242E. PMID 22763414.
- ^ Гуо X., Ушаков С.В., Лабс С., Куртиус Х., Босбах Д., Навроцкий А. (2015). «Энергетика метастудтита и последствия для преобразования ядерных отходов». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 111 (20): 17737–17742. Дои:10.1073 / pnas.1421144111. ЧВК 4273415. PMID 25422465.CS1 maint: несколько имен: список авторов (связь)
- ^ Андер Л., Смит Б. (2002) "Приложение F: Моделирование переноса грунтовых вод" Опасность для здоровья боеприпасов с обедненным ураном, часть II (Лондон: Королевское общество)
- ^ Смит Б. (2002) "Приложение G: Коррозия DU и сплавов DU: краткое обсуждение и обзор" Опасность для здоровья боеприпасов с обедненным ураном, часть II (Лондон: Королевское общество)
- ^ Морроу, PE, Гибб FR, Beiter HD (1972). «Ингаляционные исследования триоксида урана». Физика здоровья. 23 (3): 273–280. Дои:10.1097/00004032-197209000-00001. PMID 4642950.CS1 maint: несколько имен: список авторов (связь) Абстрактные
- ^ Саттон М, Бурастеро С.Р. (2004). «Растворимость и видообразование урана (VI) в смоделированных элементарных биологических жидкостях человека». Химические исследования в токсикологии. 17 (11): 1468–1480. Дои:10.1021 / tx049878k. PMID 15540945.
- ^ Сато Т. (1963). «Приготовление гидратов пероксида урана». Журнал прикладной химии. 13 (8): 361–365. Дои:10.1002 / jctb.5010130807.
- ^ Дебец П.С., Лупстра Б.О. (1963). «Об уранатах аммония II: рентгеновское исследование соединений в системе NH.3-UO3-H2O ». Журнал неорганической и ядерной химии. 25 (8): 945–953. Дои:10.1016/0022-1902(63)80027-5.
- ^ Дебец П.С. (1966). «Структура β-UO3». Acta Crystallographica. 21 (4): 589–593. Дои:10.1107 / S0365110X66003505.
- ^ Энгманн Р., де Вольф PM (1963). «Кристаллическая структура γ-UO.3" (PDF). Acta Crystallographica. 16 (10): 993–996. Дои:10.1107 / S0365110X63002656.
- ^ М. Т. Веллер; П. Г. Диккенс; Д. Дж. Пенни (1988). «Структура δ-UO3>". Многогранник. 7 (3): 243–244. Дои:10.1016 / S0277-5387 (00) 80559-8.
- ^ Сигел С., Хэкстра Х.Р., Шерри Э. (1966). «Кристаллическая структура UO высокого давления.3". Acta Crystallographica. 20 (2): 292–295. Дои:10.1107 / S0365110X66000562.
- ^ Гмелин Handbuch (1982) U-C1, 129–135.
- ^ Рекомендации В архиве 2012-07-14 в Archive.today. Kristall.uni-mki.gwdg.de. Проверено 19 июля 2011.
- ^ Захариасен (1978). «Длины связи в кислородных и галогенных соединениях d и f элементов». J. Менее распространенные встречи. 62: 1–7. Дои:10.1016/0022-5088(78)90010-3.
- ^ www.ccp14.ac.uk/ccp/web-mirrors/i_d_brown Бесплатная загрузка программного обеспечения. Ccp14.ac.uk. Проверено 19 июля 2011.
- ^ www.ccp14.ac.uk/solution/bond_valence/ Зеркало бесплатного скачивания программного обеспечения. Ccp14.ac.uk (13 августа 2001 г.). Проверено 19 июля 2011.
- ^ Акерманн Р.Дж., Жиль П.В., Торн Р.Дж. (1956). «Высокотемпературные термодинамические свойства диоксида урана». Журнал химической физики. 25 (6): 1089. Дои:10.1063/1.1743156.
- ^ Александр CA (2005). «Улетучивание урана в сильно окислительных условиях». Журнал ядерных материалов. 346 (2–3): 312–318. Дои:10.1016 / j.jnucmat.2005.07.013.
- ^ Габельник С.Д., Риди Г.Т., Часанов М.Г. (1973). "Инфракрасные спектры матрично-изолированных частиц оксида урана. II: Спектральная интерпретация и структура UO.3". Журнал химической физики. 59 (12): 6397–6404. Дои:10.1063/1.1680018.
- ^ Pyykkö P, Li J (1994). «Квазирелятивистское исследование псевдопотенциала видов, изоэлектронных уранилу, и экваториальной координации уранила». Журнал физической химии. 98 (18): 4809–4813. Дои:10.1021 / j100069a007.
- ^ Подождите, Э. (1955). «Кубическая форма триоксида урана». Журнал неорганической и ядерной химии. 1 (4–5): 309–312. Дои:10.1016 / 0022-1902 (55) 80036-X.
- ^ Бут HS, Красный-Эрген W, Хит RE (1946). «Тетрафторид урана». Журнал Американского химического общества. 68 (10): 1969–1970. Дои:10.1021 / ja01214a028.
- ^ Трофимов Т.И., Самсонов М.Д., Ли С.К., Мясоедов Б.Ф., Вай С.М. (2001). «Растворение оксидов урана в сверхкритическом диоксиде углерода, содержащем три-п-бутилфосфат и теноилтрифторацетон ». Mendeleev Communications. 11 (4): 129–130. Дои:10.1070 / MC2001v011n04ABEH001468.
- ^ Дуэбер, Р. Э. (1992). «Исследование механизма образования соединений внедрения оксидов урана путем вольтамперометрического восстановления твердой фазы после механического переноса на углеродный электрод». Журнал Электрохимического общества. 139 (9): 2363–2371. Дои:10.1149/1.2221232.
- ^ Диккенс П. Г., Лоуренс С. Д., Пенни Д. Д., Пауэлл А. В. (1989). «Вставки из оксидов урана». Ионика твердого тела. 32–33: 77–83. Дои:10.1016/0167-2738(89)90205-1.
- ^ Диккенс, П. Хоук, С.В. Веллер, М. (1985). "Введение лития в αUO3 и ты3О8". Бюллетень материаловедения. 20 (6): 635–641. Дои:10.1016/0025-5408(85)90141-2.CS1 maint: несколько имен: список авторов (связь)
- ^ Диккенс, П. Хоук, С.В. Веллер, М. (1984). «Водородные вставки UO3". Бюллетень материаловедения. 19 (5): 543–547. Дои:10.1016 / 0025-5408 (84) 90120-Х.CS1 maint: несколько имен: список авторов (связь)
- ^ Коттон, Саймон (1991). Лантаноиды и актиниды. Нью-Йорк: Издательство Оксфордского университета. п. 128. ISBN 978-0-19-507366-9.