WikiDer > Оксид кобальта (II, III)
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК оксид кобальта (II), дикобальта (III) | |
| Другие имена оксид кобальта, оксид кобальта (II, III), оксид кобальта, четырехокись трикобальта | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.013.780 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| Co3О4 CoO.Co2О3 | |
| Молярная масса | 240,80 г / моль |
| Внешность | черное твердое вещество |
| Плотность | 6,07 г / см3[2] |
| Температура плавления | 895 ° С (1643 ° F, 1168 К) |
| Точка кипения | 900 ° С (1650 ° F, 1170 К) (разлагается) |
| Нерастворимый | |
| Растворимость | растворим (с разложением) в кислоты и щелочи |
| +7380·10−6 см3/ моль | |
| Структура | |
| кубический | |
| Fd3м, №227[3] | |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H317, H334, H350, H411 | |
| P261, P273, P284, P304 + 340, P342 + 311 | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Оксид кобальта (II, III) является неорганическое соединение с формула Co3О4. Это один из двух хорошо охарактеризованных оксиды кобальта. Это черный антиферромагнитный твердый. Как соединение со смешанной валентностью, его формулу иногда записывают как CoIICoIII2О4 а иногда как CoO • Co2О3.[4]
Структура
Co3О4 принимает нормальная структура шпинели, с Co2+ в тетраэдрических междоузлиях и Co3+ ионов в октаэдрических пустотах кубический плотно упакованный решетка из окись анионы.[4]
 | 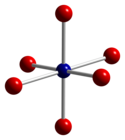 |  |
| тетраэдрическая координационная геометрия Co (II) | искаженный октаэдрическая координационная геометрия Co (III) | искаженная тетраэдрическая координационная геометрия O |
Синтез
Оксид кобальта (II), CoO, преобразуется в Co3О4 при нагревании до 600–700 ° С на воздухе.[4] При температуре выше 900 ° C CoO стабилен.[4][5] Эти реакции описываются следующим равновесием:
- 2 Co3О4 ⇌ 6 CoO + O2
Приложения
Оксид кобальта (II, III) используется в качестве синего красителя для керамика эмаль и стекло, как альтернатива оксиду кобальта (II).[6]
Оксид кобальта (II, III) используется в качестве электрода в некоторых литий-ионные батареи, возможно, в виде наночастицы оксида кобальта.
Безопасность
Соединения кобальта в больших количествах потенциально ядовиты.[7]
Смотрите также
Рекомендации
- ^ «Оксид кобальта (II, III) 203114». Сигма-Олдрич.
- ^ Лиде, Дэвид Р., изд. (2006). CRC Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 0-8493-0487-3.
- ^ «mp-18748: Co3O4 (куб., Fd-3m, 227)». materialsproject.org. Получено 2019-12-20.
- ^ а б c d Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 1118. ISBN 978-0-08-037941-8.
- ^ Справочник по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. п. 1520.
- ^ Фрэнк Хамер, Джанет Хамер (2004): Словарь материалов и методов Гончара. Пресса Пенсильванского университета; 437 стр. ISBN 0812238109
- ^ MSDS[постоянная мертвая ссылка]
