WikiDer > Тантал - Википедия
 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Тантал | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | /ˈтæптəлəм/ | |||||||||||||||||||||||||||||||||||||||||||||||
| Внешность | серый синий | |||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес Аг, стд(Та) | 180.94788(2)[1] | |||||||||||||||||||||||||||||||||||||||||||||||
| Тантал в периодическая таблица | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 73 | |||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 6 | |||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | |||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Переходный металл | |||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Xe] 4f14 5d3 6 с2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 11, 2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза вSTP | твердый | |||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 3290 K (3017 ° С, 5463 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 5731 К (5458 ° С, 9856 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (возлеr.t.) | 16,69 г / см3 | |||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (приm.p.) | 15 г / см3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 36.57 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 753 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,36 Дж / (моль · К) | |||||||||||||||||||||||||||||||||||||||||||||||
Давление газа
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | −3, −1, 0, +1, +2, +3, +4, +5 (мягко кислый окись) | |||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Радиус атома | эмпирические: 146вечера | |||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 170 ± 8 часов вечера | |||||||||||||||||||||||||||||||||||||||||||||||
| Спектральные линии тантала | ||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | изначальный | |||||||||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | объемно-центрированная кубическая (скрытая копия)[2] α-Ta | |||||||||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | четырехугольный[2] β-Та | |||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 3400 м / с (при 20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 6,3 мкм / (м · К) (при 25 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 57,5 Вт / (м · К) | |||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 131 нОм · м (при 20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | парамагнитный[3] | |||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | +154.0·10−6 см3/ моль (293 К)[4] | |||||||||||||||||||||||||||||||||||||||||||||||
| Модуль для младших | 186 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 69 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 200 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.34 | |||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 870–1200 МПа | |||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 440–3430 МПа | |||||||||||||||||||||||||||||||||||||||||||||||
| Количество CAS | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Андерс Густав Экеберг (1802) | |||||||||||||||||||||||||||||||||||||||||||||||
| Признанный отдельным элемент к | Генрих Роуз (1844) | |||||||||||||||||||||||||||||||||||||||||||||||
| Главный изотопы тантала | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Тантал это химический элемент с символ Та и атомный номер 73. Ранее известный как тантал, он назван в честь ТанталЗлодей из греческой мифологии.[5] Тантал - редкий, твердый, серо-голубой, блестящий переходный металл что очень устойчиво к коррозии. Это часть тугоплавкие металлы группы, которые широко используются в качестве второстепенных компонентов в сплавах. Химическая инертность тантала делает его ценным веществом для лабораторного оборудования и заменителем платина. Его основное использование сегодня находится в танталовые конденсаторы в электронный такое оборудование как мобильные телефоны, DVD плееры, системы видеоигр и компьютеры.Тантал всегда вместе с химически подобными ниобий, происходит в минеральная группы танталит, колумбит и колтан (смесь колумбита и танталита, хотя и не признана отдельным минеральным видом).[6] Тантал считается технологически важный элемент.
История
Тантал был открыт в Швеция в 1802 г. Андерс Экеберг, в двух пробах минералов - из Швеции и Финляндии.[7][8] Годом ранее Чарльз Хэтчетт обнаружил колумбий (теперь ниобий),[9] а в 1809 г. английский химик Уильям Хайд Волластон сравнил его оксид, колумбит плотностью 5,918 г / см3, к танталу, танталит плотностью 7,935 г / см3. Он пришел к выводу, что эти два оксида, несмотря на разницу в измеренной плотности, были идентичны, и сохранил название тантал.[10] После Фридрих Вёлер подтвердив эти результаты, считалось, что колумбий и тантал были одним и тем же элементом. Этот вывод был оспорен в 1846 г. немецким химиком. Генрих Роуз, который утверждал, что в образце танталита было два дополнительных элемента, и назвал их в честь детей Тантал: ниобий (из Ниоба, богиня слез) и пелопиум (от Pelops).[11][12] Предполагаемый элемент «пелопий» позже был идентифицирован как смесь тантала и ниобия, и было обнаружено, что ниобий идентичен колумбию, уже обнаруженному в 1801 году Хэтчеттом.
Различия между танталом и ниобием были недвусмысленно продемонстрированы в 1864 г. Кристиан Вильгельм Бломстранд,[13] и Анри Этьен Сент-Клер Девиль, а также Луи Дж. Трост, который определил эмпирические формулы некоторых своих соединений в 1865 году.[13][14] Дополнительное подтверждение пришло от швейцарского химика. Жан Шарль Галиссар де Мариньяк,[15] в 1866 г., который доказал, что элементов было всего два. Эти открытия не помешали ученым публиковать статьи о так называемых ильмений до 1871 г.[16] Де Мариньяк был первым, кто произвел металлическую форму тантала в 1864 году, когда он уменьшенный хлорид тантала путем нагревания в атмосфере водород.[17] Ранние исследователи смогли получить только нечистый тантал, а первый относительно чистый пластичный металл был произведен Вернер фон Болтон в Шарлоттенбург в 1903 году. Провода из металлического тантала использовались для лампочка нитей до вольфрам заменил его в широком использовании.[18]
Название тантал произошло от названия мифологического Тантал, отец Ниоба в Греческая мифология. По сюжету, он был наказан после смерти, будучи приговоренным стоять по колено в воде с прекрасными фруктами, растущими над его головой, и то и другое вечно. дразнящий ему. (Если он наклонился, чтобы выпить воду, вода стекала ниже того уровня, которого он мог достичь, а если он потянулся за плодом, ветви выскользнули из его рук).[19] Андерс Экеберг написал: «Этот металл я называю тантал ... отчасти в связи с его неспособностью при погружении в кислоту поглощать любые вещества и насыщаться ".[20]
На протяжении десятилетий коммерческая технология отделения тантала от ниобия включала фракционная кристаллизация из гептафтортанталат калия от моногидрата оксипентафторониобата калия, процесс, который был открыт Жан Шарль Галиссар де Мариньяк в 1866 г. Этот метод был вытеснен экстракция растворителем из фторидсодержащих растворов тантала.[14]
Характеристики
Физические свойства
Тантал темный (серо-голубой),[21] плотный, пластичный, очень твердый, простой в изготовлении и обладающий высокой проводимостью тепла и электричества. Металл известен своей устойчивостью к коррозия к кислоты; Фактически, при температуре ниже 150 °C тантал почти полностью невосприимчив к атакам обычно агрессивных царская водка. Его можно растворить плавиковая кислота или кислые растворы, содержащие фторид ион и триоксид серы, а также с раствором гидроксид калия. Высокая температура плавления тантала 3017 ° C (точка кипения 5458 ° C) среди элементов превосходит только вольфрам, рений и осмий для металлов и углерод.
Тантал существует в двух кристаллических фазах, альфа и бета. Альфа-фаза относительно пластичный и мягкий; она имеет объемно-центрированная кубическая структура (космическая группа Im3m, постоянная решетки а = 0,33058 нм), Твердость по Кнупу 200–400 ГН и удельное электрическое сопротивление 15–60 мкОм⋅см. Бета-фаза твердая и хрупкая; его кристаллическая симметрия четырехугольный (космическая группа P42 / мм, а = 1,0194 нм, c = 0,5313 нм), твердость по Кнупу составляет 1000–1300 HN, а удельное электрическое сопротивление относительно высокое - 170–210 мкОм⋅см. Бета-фаза метастабильна и превращается в альфа-фазу при нагревании до 750–775 ° C. Объемный тантал почти полностью состоит из альфа-фазы, а бета-фаза обычно существует в виде тонких пленок.[22] получен магнетрономраспыление, химическое осаждение из паровой фазы или же электрохимическое осаждение из эвтектика расплав солевого раствора.[23]
Изотопы
Природный тантал состоит из двух изотопы: 180 мТа (0,012%) и 181Та (99,988%). 181Та - это стабильный изотоп. 180 мТа (м обозначает метастабильное состояние) предсказывается тремя способами: изомерный переход к основное состояние из 180Та, бета-распад к 180W, или захват электрона на 180Hf. Однако радиоактивность этого ядерный изомер никогда не соблюдался, и только нижний предел его период полураспада 2,0 × 1016 лет было установлено.[24] Основное состояние 180Период полураспада Ta составляет всего 8 часов. 180 мТа - единственный встречающийся в природе ядерный изомер (без учета радиогенный и космогенный короткоживущие нуклиды). Это также самый редкий первичный изотоп во Вселенной, принимая во внимание изотопное содержание тантала и его изотопное содержание. 180 мTa в естественной смеси изотопов (и снова за исключением радиогенных и космогенных короткоживущих нуклидов).[25]
Тантал был рассмотрен теоретически как "засолка"материал для ядерное оружие (кобальт - наиболее известный гипотетический засолочный материал). Внешняя оболочка 181Та будет облучаться интенсивным потоком нейтронов высокой энергии от гипотетического взрывающегося ядерного оружия. Это превратит тантал в радиоактивный изотоп. 182Ta, имеющий период полураспада 114,4 суток и производит гамма излучение с энергией примерно 1,12 миллиона электрон-вольт (МэВ) на каждого, что значительно повысит радиоактивность радиоактивные осадки от взрыва несколько месяцев. Насколько известно, такое «соленое» оружие никогда не производилось и не испытывалось, и уж точно никогда не использовалось в качестве оружия.[26]
Тантал может использоваться в качестве материала мишени для пучков ускоренных протонов для производства различных короткоживущих изотопов, включая 8Ли, 80Rb и 160Yb.[27]
Химические соединения
Тантал образует соединения со степенями окисления от -III до + V. Чаще всего встречаются оксиды Ta (V), который включает все минералы. Химические свойства Ta и Nb очень похожи. В водных средах Ta проявляет только степень окисления + V. Как и ниобий, тантал плохо растворяется в разбавленных растворах соляной, серный, азотный и фосфорные кислоты из-за осаждения водного оксида Ta (V).[28] В основных средах Та может быть солюбилизирован за счет образования полиоксотанталатных соединений.[29]
Оксиды, нитриды, карбиды, сульфиды
Пятиокись тантала (Та2О5) является наиболее важным соединением с точки зрения приложений. Оксиды тантала в более низких степенях окисления многочисленны, в том числе многие дефектные конструкции, слабо изучены или плохо охарактеризованы.[30]
Танталаты, соединения, содержащие [TaO4]3− или [TaO3]− многочисленны. Литий танталат (LiTaO3) принимает структуру перовскита. Лантан танталат (LaTaO4) содержит изолированные ТаО3−
4 тетраэдры.[31]
Как и в случае с другими тугоплавкие металлы, самые твердые из известных соединений тантала - нитриды и карбиды. Карбид тантала, TaC, как и более часто используемый карбид вольфрама, это сложно керамика который используется в режущих инструментах. Нитрид тантала (III) используется в качестве тонкопленочного изолятора в некоторых процессах изготовления микроэлектроники.[32]
Наиболее изученным халькогенидом является TaS.2, слоистый полупроводник, как и другие дихалькогениды переходных металлов. Сплав тантал-теллур образует квазикристаллы.[31]
Галогениды
Галогениды тантала охватывают степени окисления +5, +4 и +3. Пентафторид тантала (TaF5) представляет собой белое твердое вещество с температурой плавления 97,0 ° C. Анион [TaF7]2- используется для его отделения от ниобия.[33] Хлорид TaCl
5, существующий в виде димера, является основным реагентом при синтезе новых соединений Ta. Легко гидролизуется до оксихлорид. Низшие галогениды TaX
4 и TaX
3, имеют связи Ta-Ta.[31][28]
Танталорганические соединения
Танталорганические соединения включают пентаметилтантал, смешанные хлориды алкилтантала, гидриды алкилтантала, алкилиденовые комплексы, а также их циклопентадиенильные производные.[34][35] Известны различные соли и замещенные производные гексакарбонила [Ta (CO)6]− и связанные изоцианиды.
Вхождение

Тантал составляет около 1промилле[36] или 2промилле[28] из Земная кора по весу. Существует множество видов минералов тантала, лишь некоторые из которых пока используются в промышленности в качестве сырья: танталит (серия, состоящая из танталита (Fe), танталита (Mn) и танталита (Mg)) микролит (теперь название группы), водгинит, эвксенит (на самом деле эвксенит- (Y)), и поликраза (на самом деле полираза- (Y)).[6] Танталит (Fe, Mn) Та2О6 является наиболее важным минералом для добычи тантала. Танталит имеет такую же минеральную структуру, что и колумбит (Fe, Mn) (Ta, Nb)2О6; когда тантала больше, чем ниобия, он называется танталитом, а когда ниобия больше, чем тантала, он называется колумбитом (или ниобит). Высокая плотность танталита и других танталосодержащих минералов делает использование гравитационное разделение лучший способ. Другие минералы включают самарскит и фергусонит.
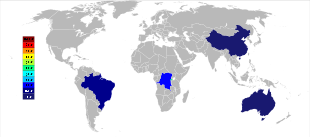
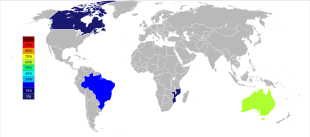
Первичная добыча тантала ведется в Австралия, где крупнейший производитель, Global Advanced Metals, ранее известный как Талисон Минералс, управляет двумя шахтами в Западной Австралии, Зеленые кусты на юго-западе и Wodgina в Пилбара область, край. Рудник Воджина был вновь открыт в январе 2011 года после того, как добыча на нем была приостановлена в конце 2008 года из-за мировой финансовый кризис.[37] Менее чем через год после открытия Global Advanced Metals объявила, что в связи с очередным «... снижением спроса на тантал ...» и другими факторами, добыча тантала должна быть прекращена в конце февраля 2012 года.[38] Wodgina производит первичный танталовый концентрат, который дополнительно модернизируется на заводе Greenbushes перед продажей покупателям.[39] В то время как крупные производители ниобия находятся в Бразилия и Канада, руда там также дает небольшой процент тантала. Некоторые другие страны, такие как Китай, Эфиопия, и Мозамбик добывают руды с более высоким содержанием тантала, и они производят значительную часть его мировой добычи. Тантал также производится в Таиланд и Малайзия как побочный продукт банка майнинг там. Во время гравитационного отделения руд от россыпных месторождений не только касситерит (SnO2), но также присутствует небольшой процент танталита. Затем шлак плавильных печей содержит экономически полезные количества тантала, который выщелачивается из шлака.[14][40]
Мировое производство тантала претерпело важный географический сдвиг с начала 21 века, когда добыча велась преимущественно в Австралии и Бразилии. Начиная с 2007 года по 2014 год, основные источники добычи тантала из шахт резко переместились в ДРК, Руанду и некоторые другие африканские страны.[41] Будущие источники поставок тантала в порядке их предполагаемого размера исследуются в Саудовская Аравия, Египет, Гренландия, Китай, Мозамбик, Канада, Австралия, то Соединенные Штаты, Финляндия, и Бразилия.[42][43]
По оценкам, запасам тантала осталось менее 50 лет, исходя из добычи при текущих темпах, что свидетельствует о необходимости увеличения переработка отходов.[44]
Статус как конфликтный ресурс
Тантал считается ресурс конфликта. Колтан, промышленное название для колумбит–танталит минерал, из которого добывают ниобий и тантал,[45] также можно найти в Центральная Африка, поэтому тантал связывают с война в Демократической Республике Конго (ранее Заир). По данным от 23 октября 2003 г. Объединенные Нации отчет,[46] контрабанда и экспорт колтана способствовали разжиганию войны в Конго, кризиса, в результате которого с 1998 года погибло около 5,4 миллиона человек.[47] - что делает его самым смертоносным задокументированным конфликтом с тех пор, как Вторая Мировая Война. Были подняты этические вопросы об ответственном корпоративном поведении, правах человека и угрозе дикой природе из-за эксплуатации таких ресурсов, как колтан, в регионах вооруженных конфликтов в бассейне Конго.[48][49][50][51] Однако, несмотря на важность для местной экономики в Конго, вклад добычи колтана в Конго в мировые поставки тантала обычно невелик. В Геологическая служба США сообщает в своем ежегоднике, что этот регион произвел немногим менее 1% мирового производства тантала в 2002–2006 годах, достигнув пика в 10% в 2000 и 2008 годах.[40]
Заявленная цель Решения для Танталового проекта Надежда заключается в том, чтобы «получить бесконфликтный тантал из Демократической Республики Конго»[52]
Производство и изготовление

Извлечение тантала из танталита осуществляется в несколько этапов. Во-первых, минерал раздавлен и сконцентрирован гравитационное разделение. Обычно это выполняется около мой сайт.
Рафинирование
Очистка тантала из его руд - один из наиболее сложных процессов разделения в промышленной металлургии. Основная проблема заключается в том, что танталовые руды содержат значительное количество ниобий, который по химическим свойствам практически идентичен Ta. Для решения этой проблемы было разработано большое количество процедур.
В наше время разделение достигается за счет гидрометаллургия.[54] Добыча начинается с выщелачивание руда с плавиковая кислота вместе с серная кислота или же соляная кислота. Этот этап позволяет отделить тантал и ниобий от различных неметаллических примесей в породе. Хотя Ta встречается в виде различных минералов, его удобно представить в виде пятиокиси, поскольку большинство оксидов тантала (V) в этих условиях ведут себя аналогичным образом. Таким образом, упрощенное уравнение для его извлечения:
- Та2О5 + 14 HF → 2 H2[TaF7] + 5 H2О
Совершенно аналогичные реакции протекают с ниобиевым компонентом, но гексафторид обычно преобладает в условиях экстракции.
- Nb2О5 + 12 HF → 2 H [NbF6] + 5 H2О
Эти уравнения упрощены: предполагается, что бисульфат (HSO4−) и хлорид конкурируют как лиганды за ионы Nb (V) и Ta (V), когда используются серная и соляная кислоты соответственно.[54] Затем фторидные комплексы тантала и ниобия удаляются из водный решение жидкость-жидкостная экстракция в органические растворители, Такие как циклогексанон, октанол, и метилизобутилкетон. Эта простая процедура позволяет удалить большинство металлосодержащих примесей (например, железо, марганец, титан, цирконий), которые остаются в водной фазе в виде фториды и другие комплексы.
Разделение тантала из ниобий затем достигается за счет снижения ионная сила кислотной смеси, которая вызывает растворение ниобия в водной фазе. Предлагается, чтобы оксифторид ЧАС2[NbOF5] формируется в этих условиях. После удаления ниобия раствор очищенного H2[TaF7] нейтрализуется водным аммиак для осаждения гидратированного оксида тантала в виде твердого вещества, которое может быть кальцинированный к пятиокись тантала (Та2О5).[55]
Вместо гидролиза H2[TaF7] можно лечить фторид калия производить гептафтортанталат калия:
- ЧАС2[TaF7] + 2 KF → K2[TaF7] + 2 ВЧ
В отличие от H2[TaF7], калиевая соль легко кристаллизируется и обрабатывается как твердое вещество.
K2[TaF7] может быть преобразован в металлический тантал с помощью снижение с натрий, примерно при 800 ° C в расплавленная соль.[56]
- K2[TaF7] + 5 Na → Ta + 5 NaF + 2 KF
В более старом методе, называемом Мариньяк процесс, смесь H2[TaF7] и H2[NbOF5] был преобразован в смесь из K2[TaF7] и K2[NbOF5], который затем был разделен фракционная кристаллизация, используя их различную растворимость в воде.
Электролиз
Тантал также можно очистить электролизом с использованием модифицированной версии Процесс Холла-Эру. Вместо того, чтобы требовать, чтобы входной оксид и выходной металл находились в жидкой форме, электролиз тантала работает на нежидких порошкообразных оксидах. Первоначальное открытие произошло в 1997 году, когда исследователи Кембриджского университета погрузили небольшие образцы определенных оксидов в ванны с расплавом соли и восстановили оксид электрическим током. Катод использует порошкообразный оксид металла. Анод выполнен из угля. Расплав соли при температуре 1000 ° C (1830 ° F) является электролитом. Мощности первого НПЗ могут удовлетворить 3–4% годовой мировой потребности.[57]
Производство и металлообработка
Все сварка тантала необходимо производить в инертной атмосфере аргон или же гелий для защиты от загрязнения атмосферными газами. Тантал не паяемый. Измельчение тантала затруднено, особенно для отожженный тантал. В отожженном состоянии тантал чрезвычайно пластичный и могут быть легко сформированы в виде металлических листов.[58]
Приложения
Электроника
В основном тантал как металлический порошок используется в производстве электронных компонентов, в основном конденсаторы и некоторые мощные резисторы. Танталовые электролитические конденсаторы использовать способность тантала образовывать защитный окись поверхностный слой, используя порошок тантала, спрессованный в форму таблетки, как одна «пластина» конденсатора, оксид как диэлектрики электролитический раствор или проводящее твердое вещество в качестве другой «пластины». Поскольку диэлектрический слой может быть очень тонким (тоньше аналогичного слоя, например, в алюминиевом электролитическом конденсаторе), емкость можно добиться в небольшом объеме. Из-за преимуществ размера и веса танталовые конденсаторы привлекательны для переносные телефоны, персональные компьютеры, автомобильная электроника и камеры.[59]
Сплавы
Тантал также используется для производства различных сплавы которые имеют высокие температуры плавления, прочность и пластичность. Легированный другими металлами, он также используется в производстве твердосплавных инструментов для металлообрабатывающего оборудования и в производстве суперсплавы для компонентов реактивных двигателей, химического технологического оборудования, ядерные реакторы, детали ракет, теплообменники, резервуары и сосуды.[60][59][61] Из-за своей пластичности тантал можно втянуть в тонкую проволоку или нити, которые используются для испарения металлов, таких как алюминий. Поскольку тантал устойчив к воздействию жидкостей организма и не вызывает раздражения, он широко используется в производстве хирургических инструментов и имплантатов. Например, пористые танталовые покрытия используются при изготовлении ортопедических имплантатов из-за способности тантала образовывать прямую связь с твердой тканью.[62]
Тантал инертен по отношению к большинству кислот, кроме плавиковая кислота и горячий серная кислотаи горячий щелочной растворы также вызывают коррозию тантала. Это свойство делает его полезным металлом для химических реакционных сосудов и труб для агрессивных жидкостей. Теплообменные змеевики для парового нагрева соляной кислоты изготовлены из тантала.[63] Тантал широко использовался в производстве сверхвысокая частота электронные лампы для радиопередатчиков. Тантал способен улавливать кислород и азот, образуя нитриды и оксиды, и поэтому помогал поддерживать высокий вакуум, необходимый для трубок, когда они используются для внутренних деталей, таких как решетки и пластины.[33][63]
Другое использование
Высокая температура плавления и стойкость к окислению позволяют использовать этот металл в производстве вакуумная печь части. Тантал чрезвычайно инертен и поэтому образует множество коррозионно-стойких деталей, таких как защитные гильзы, корпуса клапанов и танталовые крепежные детали. Благодаря высокой плотности, кумулятивный заряд и пенетратор взрывной формы лайнеры были изготовлены из тантала.[64] Тантал значительно увеличивает бронепробиваемость кумулятивного заряда из-за его высокой плотности и высокой температуры плавления.[65][66] Он также иногда используется в драгоценных часы например из Audemars Piguet, F.P. Журн, Hublot, Montblanc, Омега, и Panerai. Тантал также очень биоинертен и используется в качестве материала для ортопедических имплантатов.[67] Высокая жесткость тантала заставляет использовать его в качестве высокопористой пены или каркаса с меньшей жесткостью для имплантатов для замены тазобедренного сустава, чтобы избежать защита от напряжений.[68] Поскольку тантал является цветным немагнитным металлом, эти имплантаты считаются приемлемыми для пациентов, проходящих процедуры МРТ.[69] Оксид используется для создания особых высоких показатель преломления стекло за камера линзы.[70]
Экологические проблемы
В области окружающей среды танталу уделяется гораздо меньше внимания, чем в других науках о Земле. Концентрация верхней корки (UCC) и соотношение Nb / Ta в верхней коре и в минералах доступны, поскольку эти измерения полезны в качестве геохимического инструмента.[71] Последнее значение концентрации в верхней части земной коры составляет 0,92 частей на миллион, а соотношение Nb / Ta (вес / вес) составляет 12,7.[72]
Имеется мало данных о концентрациях тантала в различных частях окружающей среды, особенно в природных водах, где даже не были получены надежные оценки концентраций «растворенного» тантала в морской и пресной воде.[73] Некоторые значения растворенных концентраций в океанах были опубликованы, но они противоречивы. Значения в пресной воде немного лучше, но во всех случаях они, вероятно, ниже 1 нг л.−1, поскольку «растворенные» концентрации в природных водах намного ниже большинства современных аналитических возможностей.[74] Для анализа требуются процедуры предварительного концентрирования, которые на данный момент не дают стабильных результатов. В любом случае, тантал присутствует в природных водах в основном в виде твердых частиц, а не в растворенном виде.[73]
Значения концентраций в почвах, донных отложениях и атмосферных аэрозолях получить легче.[73] Значения в почвах близки к 1 ppm и, следовательно, к значениям UCC. Это указывает на детритовое происхождение. Для атмосферных аэрозолей доступные значения разбросаны и ограничены. Когда наблюдается обогащение тантала, это, вероятно, связано с потерей более водорастворимых элементов в аэрозолях в облаках.[75]
Загрязнение, связанное с использованием элемента человеком, не обнаружено.[76] Тантал является очень консервативным элементом с точки зрения биогеохимии, но его цикличность и реакционная способность до сих пор полностью не изучены.
Меры предосторожности
Соединения, содержащие тантал, в лаборатории встречаются редко. Металл очень биосовместимый[67] и используется для тела имплантаты и покрытия, поэтому внимание может быть сосредоточено на других элементах или физической природе химическое соединение.[77]
Люди могут подвергаться воздействию тантала на рабочем месте при вдыхании, контакте с кожей или глазами. В Управление по охране труда (OSHA) установил законный предел (допустимый предел воздействия) для воздействия тантала на рабочем месте как 5 мг / м3 за 8-часовой рабочий день. В Национальный институт охраны труда и здоровья (NIOSH) установил рекомендуемый предел воздействия (REL) 5 мг / м3 более 8-часовой рабочий день и краткосрочный предел 10 мг / м33. На уровне 2500 мг / м3, тантал сразу опасно для жизни и здоровья.[78]
Рекомендации
- ^ Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ а б Moseley, P.T .; Сибрук, К. Дж. (1973). «Кристаллическая структура β-тантала». Acta Crystallographica Раздел B Структурная кристаллография и кристаллохимия. 29 (5): 1170–1171. Дои:10.1107 / S0567740873004140.
- ^ Лиде, Д. Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». CRC Справочник по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Роберт (1984). CRC, Справочник по химии и физике. Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
- ^ Еврипид, Орест
- ^ а б "Mindat.org - Шахты, полезные ископаемые и многое другое". www.mindat.org.
- ^ Экеберг, Андерс (1802). «О свойствах земли иттрия по сравнению со свойствами глюцина; ископаемых, в которых содержится первая из этих земель; и об открытии металлической природы (танталия)». Журнал естественной философии, химии и искусств. 3: 251–255.
- ^ Экеберг, Андерс (1802). "Uplysning om Ytterjorden egenskaper, i synnerhet i aemforelse med Berylljorden: om de Fossilier, havari förstnemnde jord innehales, samt om en ny uptäckt kropp af metallik natur". Kungliga Svenska Vetenskapsakademiens Handlingar. 23: 68–83.
- ^ Гриффит, Уильям П .; Моррис, Питер Дж. Т. (2003). "Чарльз Хэтчетт FRS (1765–1847), химик и первооткрыватель ниобия". Примечания и отчеты Лондонского королевского общества. 57 (3): 299–316. Дои:10.1098 / RSNR.2003.0216. JSTOR 3557720. S2CID 144857368.
- ^ Волластон, Уильям Хайд (1809). «О тождестве колумбия и тантала». Философские труды Лондонского королевского общества. 99: 246–252. Дои:10.1098 / рстл.1809.0017. JSTOR 107264. S2CID 110567235.
- ^ Роза, Генрих (1844). "Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall". Annalen der Physik (на немецком). 139 (10): 317–341. Bibcode:1844AnP ... 139..317R. Дои:10.1002 / andp.18441391006.
- ^ Роза, Генрих (1847). "Ueber die Säure im Columbit von Nordamérika". Annalen der Physik (на немецком). 146 (4): 572–577. Bibcode:1847AnP ... 146..572R. Дои:10.1002 / andp.18471460410.
- ^ а б Мариньяк, Бломстранд; Х. Девиль; Л. Трост и Р. Херманн (1866). "Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure". Журнал аналитической химии Фрезениуса. 5 (1): 384–389. Дои:10.1007 / BF01302537. S2CID 97246260.
- ^ а б c Gupta, C.K .; Сури, А. К. (1994). Добывающая металлургия ниобия. CRC Press. ISBN 978-0-8493-6071-8.
- ^ Мариньяк, М. (1866). "Исследования по комбинезонам ниобия". Annales de Chimie et de Physique (На французском). 4 (8): 7–75.
- ^ Германн, Р. (1871). "Fortgesetzte Untersuchungen über die Verbindungen von Ilmenium und Niobium, sowie über die Zusammensetzung der Niobmineralien (Дальнейшие исследования соединений ильмения и ниобия, а также состава минералов ниобия)". Journal für Praktische Chemie (на немецком). 3 (1): 373–427. Дои:10.1002 / prac.18710030137.
- ^ «Ниобий». Universidade de Coimbra. Получено 2008-09-05.
- ^ Бауэрс, Б. (2001). «Сканирование нашего прошлого из Лондона. Лампа накаливания и новые материалы». Труды IEEE. 89 (3): 413. Дои:10.1109/5.915382. S2CID 28155048.
- ^ Лемприер, Джон (1887). Классический словарь Лемприера. п.659.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 1138. ISBN 978-0-08-037941-8.
- ^ Колакис, Марианте; Маселло, Мэри Джоан (30.06.2007). «Тантал». Классическая мифология и многое другое: рабочая тетрадь. ISBN 978-0-86516-573-1.
- ^ Магнусон, М .; Гречинский, Г .; Eriksson, F .; Hultman, L .; Хогберг, Х. (2019). «Электронная структура пленок β-Ta по данным рентгеновской фотоэлектронной спектроскопии и расчетов из первых принципов». Прикладная наука о поверхности. 470: 607–612. Bibcode:2019ApSS..470..607M. Дои:10.1016 / j.apsusc.2018.11.096.
- ^ Lee, S .; Doxbeck, M .; Mueller, J .; Cipollo, M .; Кот, П. (2004). «Текстура, структура и фазовые превращения в покрытии из бета-тантала с напылением». Технология поверхностей и покрытий. 177–178: 44. Дои:10.1016 / j.surfcoat.2003.06.008.
- ^ Халт, Микаэль; Вислендер, Дж. С. Элизабет; Мариссенс, Герд; Гаспарро, Жоэль; Wätjen, Uwe; Мисиашек, Марцин (2009). «Поиск радиоактивности 180mTa с использованием подземного сэндвич-спектрометра HPGe». Прикладное излучение и изотопы. 67 (5): 918–921. Дои:10.1016 / j.apradiso.2009.01.057. PMID 19246206.
- ^ Ауди, Жорж; Берсильон, Оливье; Blachot, Жан; Вапстра, Алдерт Хендрик (2003), "ТогдаUBASE оценка ядерных и распадных свойств », Ядерная физика A, 729: 3–128, Bibcode:2003НуФА.729 .... 3А, Дои:10.1016 / j.nuclphysa.2003.11.001
- ^ Победа, Дэвид Тин; Аль Масум, Мохаммед (2003). "Оружие массового поражения" (PDF). Успенский университетский журнал технологий. 6 (4): 199–219.
- ^ "Выходы танталовых мишеней - База данных ISAC по выходам - TRIUMF: Канадская национальная лаборатория элементарной и ядерной физики". mis.triumf.ca.
- ^ а б c Агулянский, Анатолий (2004). Химия фторидных соединений тантала и ниобия.. Эльзевир. ISBN 978-0-444-51604-6. Получено 2008-09-02.
- ^ Deblonde, Gauthier J. -P .; Чаннес, Александр; Белэр, Сара; Кот, Жерар (01.07.2015). «Растворимость ниобия (V) и тантала (V) в мягких щелочных условиях». Гидрометаллургия. 156: 99–106. Дои:10.1016 / j.hydromet.2015.05.015. ISSN 0304-386X.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ а б c Холлеман, А. Ф .; Wiberg, E .; Виберг, Н. (2007). Lehrbuch der Anorganischen Chemie (на немецком языке) (102-е изд.). де Грюйтер. ISBN 978-3-11-017770-1.
- ^ Цукимото, S .; Moriyama, M .; Мураками, Масанори (1961). «Микроструктура тонких пленок аморфного нитрида тантала». Тонкие твердые пленки. 460 (1–2): 222–226. Bibcode:2004TSF ... 460..222T. Дои:10.1016 / j.tsf.2004.01.073.
- ^ а б Суассон, Дональд Дж .; McLafferty, J. J .; Пьер, Джеймс А. (1961). «Отчет о сотрудничестве персонала и промышленности: тантал и ниобий». Ind. Eng. Chem. 53 (11): 861–868. Дои:10.1021 / ie50623a016.
- ^ Шрок, Ричард Р. (1979-03-01). «Алкилиденовые комплексы ниобия и тантала». Отчеты о химических исследованиях. 12 (3): 98–104. Дои:10.1021 / ar50135a004. ISSN 0001-4842.
- ^ Морс, П. М .; и другие. (2008). «Этиленовые комплексы ранних переходных металлов: кристаллические структуры [HfEt
4(C
2ЧАС
4)2−
] и виды с отрицательным окислительным состоянием [TaHEt (C
2ЧАС
4)3−
3] и [WH (C
2ЧАС
4)3−
4]". Металлоорганические соединения. 27 (5): 984. Дои:10.1021 / om701189e. - ^ Эмсли, Джон (2001). «Тантал». Строительные блоки природы: руководство по элементам от А до Я. Оксфорд, Англия, Великобритания: Издательство Оксфордского университета. п.420. ISBN 978-0-19-850340-8.
- ^ «Talison Tantalum планирует перезапуск Wodgina в середине 2011 года 09.06.2010». Рейтер. 2010-06-09. Получено 2010-08-27.
- ^ Эмери, Кейт (24 января 2012 г.). «GAM закрывает танталовый рудник Wodgina». Западная Австралия. Архивировано из оригинал 4 декабря 2012 г.. Получено 20 марта 2012.
Снижение спроса на тантал во всем мире и задержки с получением разрешения правительства на установку необходимого дробильного оборудования являются одними из факторов, способствующих принятию этого решения.
- ^ "Wodgina Operations". Global Advanced Metals. 2008 г.. Получено 2011-03-28.
- ^ а б Папп, Джон Ф. (2006). "Ежегодник минералов 2006 г. Nb & Ta". Геологическая служба США. Получено 2008-06-03.
- ^ Блейвас, Дональд I .; Папп, Джон Ф .; Ягер, Томас Р. (2015). "Изменение мирового производства танталовых рудников, 2000–2014 гг." (PDF). Геологическая служба США.
- ^ М. Дж. (Ноябрь 2007 г.). «Танталовая добавка» (PDF). Горный журнал. Получено 2008-06-03.
- ^ «Международные ресурсы тантала - разведка и добыча» (PDF). Бюллетень GSWA по минеральным ресурсам. 22 (10). Архивировано из оригинал (PDF) на 2007-09-26.
- ^ Мойер, Майкл (2010). «Сколько осталось?». Scientific American. 303 (3): 74–81. Bibcode:2010SciAm.303c..74M. Дои:10.1038 / scientificamerican0910-74. PMID 20812483.
- ^ Тантал-ниобиевый международный исследовательский центр: Колтан Проверено 27 января 2008 г.
- ^ "S / 2003/1027". 2003-10-26. Получено 2008-04-19.
- ^ «Специальный доклад: Конго». Международный комитет спасения. Получено 2008-04-19.
- ^ Хейс, Карен; Бердж, Ричард (2003). Coltan Mining в Демократической Республике Конго: как отрасли, использующие тантал, могут участвовать в восстановлении ДРК. Фауна и Флора. С. 1–64. ISBN 978-1-903703-10-6.
- ^ Дизолеле, Мвемба Фезо (6 января 2011 г.). "Кровавый колтан Конго". Пулитцеровский центр кризисных сообщений. Получено 2009-08-08.
- ^ «Война в Конго и роль Колтана». Архивировано из оригинал на 2009-07-13. Получено 2009-08-08.
- ^ «Добыча колтана в бассейне реки Конго». Архивировано из оригинал на 2009-03-30. Получено 2009-08-08.
- ^ "'Решения для надежды «Танталовый проект предлагает решения и вселяет надежду для жителей ДРК». Сеть решений. Получено 18 сентября 2014.
- ^ «Программа минеральных ресурсов». Minerals.usgs.gov. Архивировано из оригинал 4 июня 2013 г.
- ^ а б Чжаоу Чжу; Чу Юн Ченг (2011). «Технология экстракции растворителем для разделения и очистки ниобия и тантала: обзор». Гидрометаллургия. 107 (1–2): 1–12. Дои:10.1016 / j.hydromet.2010.12.015.
- ^ Агулянский, Анатолий (2004). Химия фторидных соединений тантала и ниобия (1-е изд.). Берлингтон: Эльзевир. ISBN 9780080529028.
- ^ Okabe, Toru H .; Садовей, Дональд Р. (1998). «Металлотермическое восстановление как электронно-опосредованная реакция». Журнал материаловедения. 13 (12): 3372–3377. Bibcode:1998JMatR..13.3372O. Дои:10.1557 / JMR.1998.0459. S2CID 98753880.
- ^ «Производство металлов: заманчивые перспективы». Экономист. 2013-02-16. Получено 2013-04-17.
- ^ «NFPA 484 - Стандарт для горючих металлов, металлических порошков и металлической пыли - издание 2002 г.» (PDF). Национальная ассоциация противопожарной защиты. NFPA. 2002-08-13. Получено 2016-02-12.
- ^ а б «Товарный отчет 2008: Тантал» (PDF). Геологическая служба США. Получено 2008-10-24.
- ^ "Танталовые продукты: танталовый лист и пластина | Admat Inc". Admat Inc. Получено 2018-08-28.
- ^ Бакман младший, Р. У. (2000). «Новые области применения тантала и танталовых сплавов». Журнал JOM Общества минералов, металлов и материалов. 52 (3): 40. Bibcode:2000JOM .... 52c..40B. Дои:10.1007 / s11837-000-0100-6. S2CID 136550744.
- ^ Cohen, R .; Della Valle, C.J .; Джейкобс, Дж. Дж. (2006). «Применение пористого тантала в тотальном эндопротезировании тазобедренного сустава». Журнал Американской академии хирургов-ортопедов. 14 (12): 646–55. Дои:10.5435/00124635-200611000-00008. PMID 17077337.
- ^ а б Балке, Кларенс В. (1935). «Колумбий и тантал». Промышленная и инженерная химия. 20 (10): 1166. Дои:10.1021 / ie50310a022.
- ^ Nemat-Nasser, Sia; Айзекс, Джон Б.; Лю, Минци (1998). «Микроструктура высокодеформированного, высокоскоростного деформированного тантала». Acta Materialia. 46 (4): 1307. Дои:10.1016 / S1359-6454 (97) 00746-5.
- ^ Уолтерс, Уильям; Куч, Уильям; Беркинс, Мэтью; Беркинс, Мэтью (2001). «Стойкость титанового сплава к проникновению струй из танталовых гильз кумулятивного заряда». Международный журнал ударной инженерии. 26 (1–10): 823. Дои:10.1016 / S0734-743X (01) 00135-X.
- ^ Рассел, Алан М .; Ли, Кок Лунг (2005). Соотношения структура-свойство в цветных металлах. Хобокен, Нью-Джерси: Wiley-Interscience. п. 218. ISBN 978-0-471-64952-6.
- ^ а б Джеральд Л. Берк (1940). «Коррозия металлов в тканях и введение в тантал». Журнал Канадской медицинской ассоциации. 43.
- ^ Блэк, Дж. (1994). «Биологические свойства тантала». Клинические материалы. 16 (3): 167–173. Дои:10.1016/0267-6605(94)90113-9. PMID 10172264.
- ^ Paganias, Christos G .; Цакотос, Джордж А .; Koutsostathis, Stephanos D .; Macheras, Джордж А. (2012). «Костная интеграция в пористых танталовых имплантатах». Индийский журнал ортопедии. 46 (5): 505–13. Дои:10.4103/0019-5413.101032. ISSN 0019-5413. ЧВК 3491782. PMID 23162141.
- ^ Musikant, Соломон (1985). «Композиция оптического стекла». Оптические материалы: введение в выбор и применение. CRC Press. п. 28. ISBN 978-0-8247-7309-0.
- ^ Зеленый, TH. (1995). «Значение Nb / Ta как индикатора геохимических процессов в системе кора-мантия». Химическая геология. 120 (3–4): 347–359. Bibcode:1995ЧГео.120..347Г. Дои:10.1016 / 0009-2541 (94) 00145-X.
- ^ Hu, Z .; Гао, С. (2008). «Содержание микроэлементов в верхней коре: пересмотр и обновление». Химическая геология. 253 (3–4): 205. Bibcode:2008ЧГео.253..205Н. Дои:10.1016 / j.chemgeo.2008.05.010.
- ^ а б c Филелла, М. (2017). «Тантал в окружающей среде». Обзоры наук о Земле. 173: 122–140. Bibcode:2017ESRv..173..122F. Дои:10.1016 / j.earscirev.2017.07.002.
- ^ Filella, M .; Родушкин, И. (2018). «Краткое руководство по определению менее изученных технологических элементов (Nb, Ta, Ga, In, Ge, Te) с помощью масс-спектрометрии с индуктивно связанной плазмой в пробах окружающей среды». Spectrochimica Acta Часть B. 141: 80–84. Bibcode:2018AcSpe.141 ... 80F. Дои:10.1016 / j.sab.2018.01.004.
- ^ Vlastelic, I .; Сучорский, К .; Селлегри, К .; Colomb, A .; Nauret, F .; Bouvier, L .; Пиро, Дж. Л. (2015). «Бюджет элементов высокой напряженности поля атмосферных аэрозолей (Пюи де Дом, Франция)». Geochimica et Cosmochimica Acta. 167: 253–268. Bibcode:2015GeCoA.167..253V. Дои:10.1016 / j.gca.2015.07.006.
- ^ Filella, M .; Родригес-Мурильо, JC. (2017). «Менее изученные ТВК: увеличиваются ли их концентрации в окружающей среде из-за их использования в новых технологиях?». Атмосфера. 182: 605–616. Bibcode:2017Чмсп.182..605Ф. Дои:10.1016 / j.chemosphere.2017.05.024. PMID 28525874.
- ^ Matsuno H; Ёкояма А; Watari F; Uo M; Кавасаки Т. (2001). «Биосовместимость и остеогенез имплантатов из тугоплавких металлов, титана, гафния, ниобия, тантала и рения. Биосовместимость тантала». Биоматериалы. 22 (11): 1253–62. Дои:10.1016 / S0142-9612 (00) 00275-1. PMID 11336297.
- ^ «CDC - Карманный справочник NIOSH по химической опасности - тантал (металлическая и оксидная пыль, как Ta)». www.cdc.gov. Получено 2015-11-24.
внешняя ссылка
| Искать тантал в Викисловаре, бесплатном словаре. |
| Викискладе есть медиафайлы по теме Тантал. |