WikiDer > Хлорид висмута
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид висмута | |
| Другие имена Трихлорид висмута, трихлорбисмут, трихлорбисмутин, хлорид висмута (III) | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.203 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| BiCl3 | |
| Молярная масса | 315,34 г / моль |
| Внешность | гигроскопичный кристаллы от белого до желтого |
| Плотность | 4,75 г / см3 |
| Температура плавления | 227 ° С (441 ° F, 500 К) |
| Точка кипения | 447 ° С (837 ° F, 720 К) |
| Растворим, гидролизуется | |
| Растворимость | растворим в метанол, диэтиловый эфир, ацетон |
| -26.5·10−6 см3/ моль | |
| Термохимия | |
Теплоемкость (C) | 0,333 Дж / (г · К) |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -1,202 кДж / г |
| Опасности | |
| Паспорт безопасности | Джей Ти Бейкер |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 3324 мг / кг, перорально (крысы) |
| Родственные соединения | |
Другой анионы | фторид висмута, субсалицилат висмута, триоксид висмута |
Другой катионы | хлорид железа (III), хлорид марганца (II), хлорид кобальта (II) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорид висмута (или же масло висмута) является неорганическое соединение с химической формулой BiCl3. Это ковалентное соединение, которое является обычным источником Bi.3+ ион. В газовой фазе и в кристалле частицы принимают пирамидальную структуру в соответствии с Теория VSEPR.
Подготовка
Хлорид висмута можно синтезировать напрямую, пропуская хлор над висмут.
- 2 Bi + 3 Cl2 → 2 BiCl3
или растворением металлического висмута в царская водка, выпаривая смесь, получают BiCl3· 2H2О, который можно перегонять с образованием безводного трихлорида.[1]
В качестве альтернативы его можно приготовить, добавив соляная кислота к оксид висмута и выпаривание раствора.
- Би2О3 + 6 HCl → 2 BiCl3 + 3 часа2О
Также соединение может быть получено растворением висмута в концентрированном азотная кислота а затем добавляем твердое тело хлорид натрия в это решение.[2]
- Би + 6 HNO3 → Bi (НЕТ3)3 + 3 часа2O + 3 НЕТ2
- Би (НЕТ3)3 + 3 NaCl → BiCl3 + 3 NaNO3
Структура
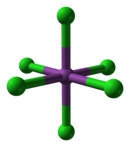
В газовой фазе BiCl3 является пирамидальной с углом Cl-Bi-Cl 97,5 ° и длиной связи 242 мкм.[3] В твердом состоянии каждый атом Bi имеет трех ближайших соседей в 250 пм, два в 324 пм и три в среднем 336 пм,[4] изображение выше выделяет трех ближайших соседей. Эта структура аналогична структуре AsCl3, AsBr3, SbCl3 и SbBr3.
Химия
Хлорид висмута гидролизованный с готовностью оксихлорид висмута, BiOCl:[5]
- Би3+
(водн.) + Cl−
(водн.) + ЧАС
2О(l) ⇌ BiOCl (s) + 2 ЧАС+
(водн.)
Эту реакцию можно обратить, добавив кислоту, такую как соляная кислота.[6]
Реакция твердого BiCl3 с водяным паром ниже 50 ° C, как было показано, дает промежуточный моногидрат BiCl3.ЧАС2О.[7]
Хлорид висмута является окислителем, который легко восстанавливается до металлического висмута восстановителями.
Хлоркомплексы
В отличие от обычных ожиданий по согласованности с периодическими тенденциями, BiCl3 это Кислота Льюиса, образуя различные хлорокомплексы, такие как [BiCl6]3− что сильно нарушает Правило октета. Кроме того, октаэдрическая структура этого координационный комплекс не следует предсказаниям теории VSEPR, поскольку одинокая пара на висмуте неожиданно стереохимически неактивен. Дианионный комплекс [BiCl5]2− однако принимает ожидаемую квадратно-пирамидальную структуру.[8]
 |  |  |
Органический катализ
Хлорид висмута используется как катализатор в органический синтез. В частности, он катализирует Реакция Майкла и Альдольная реакция Мукаяма. Добавление другого металла йодиды увеличивает его каталитическую активность.[9]
Безопасность
Хлорид висмута токсичен. Вызывает раздражение желудочно-кишечного тракта и дыхательных путей. Попадание на кожу может вызвать ожоги.
Рекомендации
- ^ Годфри, С. М .; McAuliffe, C.A .; Mackie, A. G .; Причард, Р. Г. (1998). Николас С. Норман (ред.). Химия мышьяка, сурьмы и висмута. Springer. п. 90. ISBN 0-7514-0389-X.
- ^ Прадёт Патнаик. Справочник неорганических химикатов. Макгроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Тёке, Орсоля и Магдолна Харгиттай. «Молекулярная структура трихлорида висмута из комбинированного исследования дифракции электронов и колебательной спектроскопии». Структурная химия 6.2 (1995): 127-130.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание, стр. 879 - 884, Oxford Science Publications, ISBN 0-19-855370-6
- ^ Джоэл Генри Хильдебранд (2008). Принципы химии. БиблиоБазар, ООО. п. 191. ISBN 978-0-559-31877-1.
- ^ Фрэнк Велчер (2008). Химические Растворы. ЧИТАТЬ КНИГИ. п. 48. ISBN 978-1-4437-2907-9.
- ^ Восилус, Арон; Хоффманн, Стефан; Шмидт, Маркус; Рак, Майкл (2010). «Исследование реакции BiCl3 на BiCl3 через промежуточный гидрат BiCl3 · H2O» на месте. Европейский журнал неорганической химии. 2010 (10): 1469–1471. Дои:10.1002 / ejic.201000032. ISSN 1434-1948.
- ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5.
- ^ Хитоми Сузуки; Ёсихиро Матано (2001). Висмуторганическая химия. Эльзевир. стр.403–404. ISBN 0-444-20528-4.
