WikiDer > Хлорид олова (II)
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Хлорид олова (II) Дихлорид олова | |
| Другие имена Олово хлорид Оловянная соль Протохлорид олова | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.028.971 |
| Номер E | E512 (регуляторы кислотности, ...) |
PubChem CID | |
| Номер RTECS |
|
| UNII |
|
| Номер ООН | 3260 |
| |
| |
| Свойства | |
| SnCl2 | |
| Молярная масса | 189.60 г / моль (безводный) 225,63 г / моль (дигидрат) |
| Внешность | Белое кристаллическое твердое вещество |
| Запах | без запаха |
| Плотность | 3,95 г / см3 (безводный) 2,71 г / см3 (дигидрат) |
| Температура плавления | 247 ° С (477 ° F, 520 К) (безводный) 37,7 ° C (дигидрат) |
| Точка кипения | 623 ° С (1153 ° F, 896 К) (разлагается) |
| 83,9 г / 100 мл (0 ° С) Гидролизует в горячей воде | |
| Растворимость | растворим в этиловый спирт, ацетон, эфир, Тетрагидрофуран не растворим в ксилол |
| −69.0·10−6 см3/ моль | |
| Структура | |
| Структура слоев (цепи SnCl3 группы) | |
| Тригонально-пирамидальный (безводный) Дигидрат также трехкоординатный | |
| Согнутый (газовая фаза) | |
| Опасности | |
| Основной опасности | Раздражает, опасен для водных организмов |
| Паспорт безопасности | Увидеть: страница данных ICSC 0955 (безводный) ICSC 0738 (дигидрат) |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 700 мг / кг (крыса, перорально) 10000 мг / кг (кролик, перорально) 250 мг / кг (мышь, перорально)[1] |
| Родственные соединения | |
Другой анионы | Фторид олова (II) Бромид олова (II) Иодид олова (II) |
Другой катионы | Дихлорид германия Хлорид олова (IV) Хлорид свинца (II) |
| Страница дополнительных данных | |
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ |
| УФ, ИК, ЯМР, РС | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Банка(II) хлористый, также известен как хлорид олова, это белый кристаллический твердое тело с формулой SnCl2. Образует стабильный дигидрат, но водный решения имеют тенденцию подвергаться гидролиз, особенно если жарко. SnCl2 широко используется как Восстановитель (в растворе кислоты), а в электролитический ванны для лужение. Хлорид олова (II) не следует путать с другим хлоридом олова; хлорид олова (IV) или хлорид олова (SnCl4).
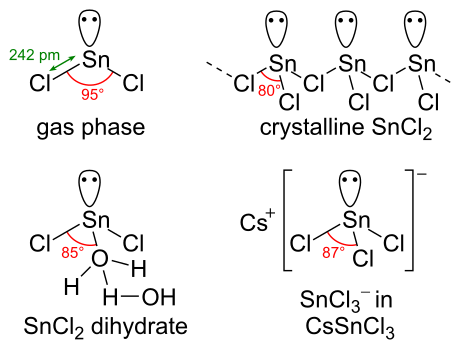
Химическая структура
SnCl2 имеет одинокая пара из электроны, так что молекула в газовой фазе изогнута. В твердом состоянии кристаллический SnCl2 образует цепочки, связанные через хлористый мосты, как показано. Дигидрат также является трехкоординатным: одна вода координируется с оловом, а вторая вода - с первой. Основная часть молекулы укладывается в двойные слои в кристаллическая решетка, со «второй» водой, зажатой между слоями.
Химические свойства
Хлорид олова (II) может растворяться в воде, меньшей, чем его собственная масса, без видимого разложения, но по мере разбавления раствора происходит гидролиз с образованием нерастворимой основной соли:
- SnCl2 (водн.) + H2O (l) ⇌ Sn (OH) Cl (s) + HCl (водн.)
Следовательно, если будут использоваться прозрачные растворы хлорида олова (II), его необходимо растворить в соляная кислота (обычно той же или большей молярности, что и хлорид олова) для поддержания равновесие по направлению к левой стороне (используя Принцип Ле Шателье). Растворы SnCl2 также неустойчивы к окисление по воздуху:
- 6 SnCl2 (водн.) + O2 (г) + 2 H2О (л) → 2 SnCl4 (водн.) + 4 Sn (OH) Cl (т)
Этого можно избежать, храня раствор над кусками металлического олова.[3]
Во многих случаях хлорид олова (II) действует как восстановитель, восстанавливающий Серебряный и золото соли металла и соли железа (III) железа (II), например:
- SnCl2 (водн.) + 2 FeCl3 (водн.) → SnCl4 (водн.) + 2 FeCl2 (водн.)
Он также восстанавливает медь (II) до меди (I).
Растворы хлорида олова (II) также могут служить просто источником Sn2+ ионы, которые могут образовывать другие соединения олова (II) через атмосферные осадки реакции. Например, реакция с сульфид натрия производит коричневый / черный сульфид олова (II):
- SnCl2 (водн.) + Na2S (водн.) → SnS (т. Е.) + 2 NaCl (водн.)
Если щелочь добавляется к раствору SnCl2, белый осадок гидратированной оксид олова (II) формируется изначально; затем он растворяется в избытке основания с образованием соли станнита, такой как станнит натрия:
- SnCl2(водн.) + 2 NaOH (водн.) → SnO · H2O (т) + 2 NaCl (водн.)
- SnO · H2O (т) + NaOH (водн.) → NaSn (OH)3 (водн.)
Безводный SnCl2 может быть использован для получения множества интересных соединений олова (II) в неводных растворителях. Например, литий поваренная соль из 4-метил-2,6-ди-трет-бутилфенол реагирует с SnCl2 в THF дать желтое линейное двухкоординатное соединение Sn (OAr)2 (Ar = арил).[4]
Хлорид олова (II) также ведет себя как Кислота Льюиса, формируя комплексы с участием лиганды такие как хлористый ion, например:
- SnCl2 (водн.) + CsCl (водн.) → CsSnCl3 (водн.)
Большинство этих комплексов пирамидальный, а так как комплексы типа SnCl3 иметь полный октет, существует небольшая тенденция к добавлению более чем одного лиганда. В одинокая пара электронов в таких комплексах доступен для связывания, и поэтому сам комплекс может действовать как База Льюиса или лиганд. Это видно в ферроценродственный продукт следующей реакции:
- SnCl2 + Fe (η5-C5ЧАС5) (CO)2HgCl → Fe (η5-C5ЧАС5) (CO)2SnCl3 + Hg
SnCl2 могут быть использованы для получения множества таких соединений, содержащих связи металл-металл. Например, реакция с дикобальт октакарбонил:
- SnCl2 + Co2(CO)8 → (СО)4Со- (SnCl2) -Co (CO)4
Подготовка
Безводный SnCl2 готовится действием сухих хлористый водород газ на банка металл. Дигидрат получают по аналогичной реакции, используя соляная кислота:
- Sn (тв) + 2 HCl (водн.) → SnCl2 (водн.) + ЧАС
2 (г)
Затем воду осторожно выпаривают из кислого раствора с образованием кристаллов SnCl.2· 2H2О. Этот дигидрат может быть обезвоженный к безводному использованию уксусный ангидрид.[5]
Использует
Раствор хлорида олова (II), содержащий немного соляная кислота используется для лужение из стали, чтобы сделать жестяные банки. Применяется электрический потенциал, и банка металл образуется на катод через электролиз.
Хлорид олова (II) используется как едкий в текстиле крашение потому что дает более яркие цвета с некоторыми красителями, например кошениль. Эта протрава также использовалась отдельно для увеличения веса шелка.
В последние годы все большее количество зубная паста бренды добавляли в свою формулу хлорид олова (II) для защиты от эрозии эмали, например. г. Орал-Б или Элмекс.
Он используется в качестве катализатора при производстве пластика. полимолочная кислота (PLA).
Он также находит применение в качестве катализатора между ацетоном и перекисью водорода для образования тетрамерной формы перекись ацетона.
Хлорид олова (II) также широко используется в качестве Восстановитель. Это видно по его использованию для серебрения зеркал, где Серебряный на стекло наносится металл:
- Sn2+ (водн.) + 2 Ag+ → Sn4+ (водн.) + 2 Ag (s)
Соответствующее сокращение традиционно использовалось в качестве аналитического теста для Hg2+(водн.). Например, если SnCl2 добавлен капельно в раствор хлорид ртути (II), белый осадок хлорид ртути (I) сначала формируется; как больше SnCl2 добавляется, он становится черным по мере образования металлической ртути. Хлорид олова можно использовать для проверки наличия золото соединения. SnCl2 становится ярким фиолетовый в присутствии золота (см. Пурпур Кассия).
Когда ртуть анализируется с помощью атомно-абсорбционной спектроскопии, необходимо использовать метод холодного пара, а хлорид олова (II) обычно используется в качестве восстановителя.
В органическая химия, SnCl2 в основном используется в Стивен редукция, посредством чего нитрил уменьшается (через имидоилхлорид соль) в я добываю который легко гидролизуется до альдегид.[6]
Реакция обычно лучше всего работает с ароматный нитрилы Арил-CN. Родственная реакция (называемая методом Зонна-Мюллера) начинается с амида, который обрабатывают PCl5 с образованием соли имидоилхлорида.
Сокращение Стивена сегодня используется реже, потому что оно в основном заменено гидрид диизобутилалюминия уменьшение.
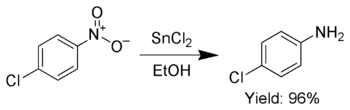
Дополнительно SnCl2 используется для выборочного уменьшения ароматный нитро группы для анилины.[7]
SnCl2 также снижает хиноны к гидрохиноны.
Хлорид олова также добавляется в качестве пищевая добавка с участием Номер E E512 некоторым консервированным продуктам и продуктам в бутылках, где он служит агент, сохраняющий цвет и антиоксидант.
SnCl2 используется в радионуклидная ангиография уменьшить радиоактивный агент технеций-99м-пертехнетат чтобы помочь в связывании с клетками крови.
Водный раствор хлорида олова используется многими любителями и профессионалами в области рафинирования драгоценных металлов в качестве индикатора золото и металлы платиновой группы в растворах.[нужна цитата]
Расплавленный SnCl2 может быть окислен с образованием высококристаллического SnO2 наноструктуры.[8][9]
Заметки
- ^ «Олово (неорганические соединения, как Sn)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Дж. М. Леже; Дж. Хейнс; А. Атуф (1996). "Поведение котуннитовой и посткотуннитовой фаз PbCl при высоком давлении.2 и SnCl2". J. Phys. Chem. Твердые тела. 57 (1): 7–16. Bibcode:1996JPCS ... 57 .... 7L. Дои:10.1016/0022-3697(95)00060-7.
- ^ Х. Нечамкин (1968). Химия элементов. Нью-Йорк: Макгроу-Хилл.
- ^ Б. Четинкая, И. Гумрукку, М. Ф. Лапперт, Дж. Л. Этвуд, Р. Д. Роджерс и М. Дж. Заворотко (1980). «Двухвалентные 2,6-ди-трет-бутилфеноксиды германия, олова и свинца, а также кристаллические и молекулярные структуры M (OC6H2Me-4-But2-2,6) 2 (M = Ge или Sn)». Варенье. Chem. Soc. 102 (6): 2088–2089. Дои:10.1021 / ja00526a054.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ У. Л. Ф. Армарего; К. Л. Чай (2009). Очистка лабораторных химикатов (6 изд.). Соединенные Штаты Америки: Баттерворт-Хайнеманн.
- ^ Уильямс, Дж. У. (1955). «β-Нафтальдегид». Органический синтез.; Коллективный объем, 3, п. 626
- ^ Ф. Д. Беллами и К. Оу (1984). «Селективное восстановление ароматических нитросоединений хлоридом олова в некислой и неводной среде». Буквы Тетраэдра. 25 (8): 839–842. Дои:10.1016 / S0040-4039 (01) 80041-1.
- ^ А. Р. Камали, Термокинетическая характеристика хлорида олова (11), J Therm Anal Calorim 118 (2014) 99-104.
- ^ Камали А.Р. и др. Превращение расплавленного SnCl.2 в SnO2 наномонокристаллы, Ceram Intern 40 (2014) 8533-8538.
использованная литература
- Н. Н. Гринвуд, А. Эрншоу, Химия элементов, 2-е изд., Баттерворт-Хайнеманн, Оксфорд, Великобритания, 1997.
- Справочник по химии и физике, 71-е издание, CRC Press, Анн-Арбор, Мичиган, 1990.
- Индекс Merck, 7-е издание, Merck & Co, Рэуэй, Нью-Джерси, США, 1960.
- А. Ф. Уэллс ».Структурная неорганическая химия, 5-е изд., Oxford University Press, Оксфорд, Великобритания, 1984.
- Дж. Марч, Продвинутая органическая химия, 4-е изд., С. 723, Вили, Нью-Йорк, 1992.