WikiDer > ANGPTL4
Ангиопоэтин-подобный 4 это белок что в человеке кодируется ANGPTL4 ген.[5][6][7] Описаны альтернативно сплайсированные варианты транскриптов, кодирующие разные изоформы. Этот ген ранее назывался ANGPTL2, HFARP, PGAR или FIAF, но был переименован в ANGPTL4.
Структура
Этот ген является членом ангиопоэтин-подобное семейство генов и кодирует гликозилированный, секретируемый белок с спиральная катушка N-концевой домен и фибриноген-любить C-терминал домен.[8]
Выражение
У мышей самые высокие уровни экспрессии мРНК ANGPTL4 обнаруживаются в белой и коричневой жировой ткани, за которой следуют печень, почки, мышцы и кишечник. ANGPTL4 человека наиболее сильно экспрессируется в печени.
Функция
Этот ген индуцируется в условиях гипоксии (низкого содержания кислорода) в различных типах клеток и является мишенью для Рецепторы, активируемые пролифератором пероксисом. Кодируемый белок представляет собой гормон сыворотки, непосредственно участвующий в регуляции липидного обмена. Нативный полноразмерный ANGPTL4 может образовывать структуры более высокого порядка через межмолекулярные дисульфидные связи. N-концевой регион ANGPTL4 (nANGPTL4) отвечает за его сборку. Полноразмерный ANGPTL4 подвергается протеолитическому расщеплению в линкерной области, высвобождая nANGPTL4 и мономерную С-концевую часть ANGPTL4 (cANGPTL4). NANGPTL4 и cANGPTL4 имеют разные биологические функции.[8] Моноклональные антитела, направленные на nANGPTL4[9] и cANGPTL4[10] были разработаны, чтобы различать их функции.
Клиническое значение
ANGPTL4 играет важную роль при многих раковых заболеваниях и участвует в метастатическом процессе, модулируя проницаемость сосудов, подвижность раковых клеток и инвазивность.[11][12][13] ANGPTL4 способствует росту опухоли и защищает клетки от Anoikis, форма запрограммированная гибель клеток индуцируется, когда контактно-зависимые клетки отделяются от окружающей тканевой матрицы.[10] ANGPTL4, секретируемый опухолями, может связываться с интегрины, активируя нижестоящую передачу сигналов и приводя к продукции супероксид продвигать туморогенез.[14] ANGPTL4 разрушает эндотелиальный клеточные соединения путем прямого взаимодействия с интегрином, VE-кадгерин и клаудин-5 последовательно, чтобы облегчить метастаз.[15] ANGPTL4, в частности C-концевой фрагмент (cANGPTL4), является ключевым игроком, который координирует увеличение потока клеточной энергии, критически важное для эпителиально-мезенхимальный переход (EMT) через сигнальную ось ANGPTL4: YWHAG (14-3-3γ).[16][17] Ось передачи сигналов ANGPTL4: YWHAG придает метаболическую гибкость и повышает компетентность EMT за счет взаимодействия со специфическими сигналами фосфорилирования на целевых белках. Прямым следствием этого является то, что ANGPTL4 обеспечивает достаточное количество клеточной энергии для подпитки множества Автовозы ABC для придания ЕМТ-опосредованной химиорезистентности.[18]
ANGPTL4 функционирует как матрицеклеточный белок[19] для облегчения заживления кожных ран. У мышей с дефицитом ANGPTL4 наблюдается замедленная реэпителизация раны с нарушением кератиноцит миграция, ангиогенез и измененный воспалительный ответ.[20][21] ANGPTL4 индуцирует оксид азота продуцирование через интегрин / JAK / STAT3-опосредованную активацию iNOS экспрессия в эпителии раны и усиливает ангиогенез для ускорения заживления ран у мышей с диабетом.[22] ANGPTL4 индуцирует опосредованную β-катенином повышающую регуляцию ID3 в фибробластах для снижения экспрессии коллагена в рубцах.[23] ANGPTL4 способен реверсировать индуцированную дифференцировкой фибробластов и миофибробластов выровненные электроспученные фиброзные субстраты.[24] Циклическое растяжение фибробластов сухожилий человека стимулировало экспрессию и высвобождение белка ANGPTL4 посредством передачи сигналов TGF-β и HIF-1α, и высвобожденный ANGPTL4 был проангиогенным.[25] ANGPTL4 также является мощным ангиогенным фактором, экспрессия которого повышается в гипоксических клетках Мюллера сетчатки in vitro и в ишемической сетчатке in vivo. Экспрессия ANGPTL4 увеличивалась в водной и стекловидном теле пациентов с пролиферативной диабетической ретинопатией и локализовалась в областях неоваскуляризации сетчатки.[26]
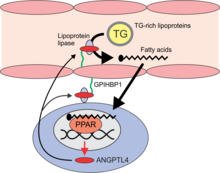
ANGPTL4 был признан сильным ингибитором сывороточного триглицерид (ТГ) клиренс, вызывающий повышение уровня ТГ в сыворотке за счет ингибирования фермента липопротеинлипаза (LPL). Биохимические исследования показывают, что ANGPTL4 частично отключает LPL за счет диссоциации каталитически активного димера LPL на неактивные мономеры LPL.[27] Однако данные также предполагают, что ANGPTL4 действует как обычный неконкурентный ингибитор, который связывается с LPL, чтобы предотвратить гидролиз субстрата как часть обратимого механизма.[28] Как следствие, ANGPTL4 нокаутные мыши имеют пониженные уровни триглицеридов в сыворотке, тогда как противоположное верно для мышей, сверхэкспрессирующих ANGPTL4. ANGPTL4 подавляет образование ячеек пены для уменьшения атеросклероз развитие.[29] Снижение активности ЛПЛ в жировая ткань в течение голодание вероятно, вызвано увеличением местного производства ANGPTL4. В других тканях, таких как сердце, производство ANGPTL4 стимулируется жирные кислоты и может служить для защиты клеток от избыточного поглощения жира.[30] ANGPTL4 в большей степени индуцируется в мышцах, не выполняющих упражнения, чем в мышцах человека во время интенсивных упражнений. Предположительно, ANGPTL4 в мышцах, не занимающихся спортом, приводит к снижению местного поглощения жирных кислот, производных триглицеридов плазмы, и их сохранению для использования при тренировке мышц. Индукции ANGPTL4 в тренирующих мышцах, вероятно, противодействуют через АМФ-активированная протеинкиназа (AMPK) -опосредованная подавляющая регуляция, способствующая использованию триглицеридов плазмы в качестве топлива для активных мышц.[31]
Высокопроизводительное секвенирование РНК образцов легочной ткани 1918 и 2009 гг. пандемия гриппа показали, что ANGPTL4 был одним из наиболее значимо активированных генов.[32] Инфекция легких мышиным гриппом стимулировала экспрессию ANGPTL4 через механизм, опосредованный STAT3. ANGPTL4 усиливал проницаемость легочной ткани и обострял повреждение легких, вызванное воспалением. У инфицированных гриппом мышей с нокаутом ANGPTL4 обнаруживалось меньшее повреждение легких и они быстрее восстанавливались после инфекции по сравнению с мышами дикого типа. Обработка инфицированных мышей нейтрализующими антителами против ANGPTL4 значительно ускорила восстановление легких и улучшила целостность легочной ткани.[33] Также было показано, что лечение антителами против ANGPTL4 уменьшает отек легких и повреждение вторичного пневмококка. пневмония.[34]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000167772 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000002289 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ким И., Ким Х.Г., Ким Х., Ким Х.Х., Пак С.К., Эм С.С. и др. (Март 2000 г.). «Печеночная экспрессия, синтез и секреция нового белка, связанного с фибриногеном / ангиопоэтином, который предотвращает апоптоз эндотелиальных клеток». Биохимический журнал. 346 (Pt 3): 603–10. Дои:10.1042/0264-6021:3460603. ЧВК 1220891. PMID 10698685.
- ^ Юн Дж.К., Чикеринг Т.В., Розен Э.Д., Дюссо Б., Цинь И, Сукас А. и др. (Июль 2000 г.). «Ген-мишень гамма рецептора, активируемого пролифератором пероксисом, кодирующий новый родственный ангиопоэтину белок, связанный с дифференцировкой жировой ткани». Молекулярная и клеточная биология. 20 (14): 5343–9. Дои:10.1128 / MCB.20.14.5343-5349.2000. ЧВК 85983. PMID 10866690.
- ^ Керстен С., Мандард С., Тан Н.С., Эшер П., Мецгер Д., Шамбон П. и др. (Сентябрь 2000 г.). «Характеристика индуцированного голоданием жирового фактора FIAF, нового гена-мишени рецептора, активируемого пролифератором пероксисом». Журнал биологической химии. 275 (37): 28488–93. Дои:10.1074 / jbc.M004029200. PMID 10862772.
- ^ а б Чжу П, Го Й., Чин Х. Ф., Керстен С., Тан Н. С. (июнь 2012 г.). «Ангиопоэтин-подобный 4: десятилетие исследований». Отчеты по бионауке. 32 (3): 211–9. Дои:10.1042 / BSR20110102. PMID 22458843.
- ^ Desai U, Lee EC, Chung K, Gao C, Gay J, Key B и др. (Июль 2007 г.). «Липидоснижающие эффекты антитела против ангиопоэтин-подобного 4 повторяют липидный фенотип, обнаруженный у ангиопоэтин-подобных 4-нокаутных мышей». Труды Национальной академии наук Соединенных Штатов Америки. 104 (28): 11766–71. Дои:10.1073 / pnas.0705041104. ЧВК 1913890. PMID 17609370.
- ^ а б Zhu P, Tan MJ, Huang RL, Tan CK, Chong HC, Pal M и др. (Март 2011 г.). «Ангиопоэтин-подобный 4-протеин повышает межклеточное соотношение O2 (-): H2O2 в процессе выживания и придает аноикису устойчивость к опухолям». Раковая клетка. 19 (3): 401–15. Дои:10.1016 / j.ccr.2011.01.018. PMID 21397862.
- ^ Padua D, Zhang XH, Wang Q, Nadal C, Gerald WL, Gomis RR, Massagué J (апрель 2008 г.). «TGFbeta подготавливает опухоли молочной железы к посеву метастазов в легкие через ангиопоэтин-подобный 4». Ячейка. 133 (1): 66–77. Дои:10.1016 / j.cell.2008.01.046. ЧВК 2390892. PMID 18394990.
- ^ Ким С.Х., Пак Й.Й., Ким С.В., Ли Дж.С., Ван Д., Дюбуа Р.Н. (ноябрь 2011 г.). «Индукция ANGPTL4 простагландином E2 в условиях гипоксии способствует прогрессированию колоректального рака». Исследования рака. 71 (22): 7010–20. Дои:10.1158 / 0008-5472.CAN-11-1262. ЧВК 3217078. PMID 21937683.
- ^ Адхикари Т., Брандт Д.Т., Каддац К., Стокерт Дж., Нарун С., Мейсснер В. и др. (Октябрь 2013). «Обратные агонисты PPARβ / δ подавляют онкогенную передачу сигнала к гену ANGPTL4 и ингибируют инвазию раковых клеток». Онкоген. 32 (44): 5241–52. Дои:10.1038 / onc.2012.549. ЧВК 3938163. PMID 23208498.
- ^ Тан MJ, Teo Z, Sng MK, Zhu P, Tan NS (июнь 2012 г.). «Новые роли ангиопоэтин-подобного 4 в развитии рака человека». Молекулярные исследования рака. 10 (6): 677–88. Дои:10.1158 / 1541-7786.MCR-11-0519. PMID 22661548.
- ^ Хуанг Р.Л., Тео З., Чонг Х.С., Чжу П., Тан М.Дж., Тан С.К. и др. (Октябрь 2011 г.). «ANGPTL4 модулирует целостность сосудистого соединения посредством передачи сигналов интегрина и нарушения межклеточных кластеров VE-кадгерина и клаудина-5». Кровь. 118 (14): 3990–4002. Дои:10.1182 / кровь-2011-01-328716. PMID 21841165.
- ^ Teo Z, Sng MK, Chan JS, Lim MM, Li Y, Li L и др. (Ноябрь 2017 г.). «Повышение энергетического заряда аденилата за счет ангиопоэтин-подобного 4 усиливает эпителиально-мезенхимальный переход путем индукции экспрессии 14-3-3γ». Онкоген. 36 (46): 6408–6419. Дои:10.1038 / onc.2017.244. ЧВК 5701092. PMID 28745316.
- ^ Тан З.В., Тео З., Тан С., Чу С.К., Лу В.С., Сонг Й и др. (Октябрь 2017 г.). «Вариант ANGPTL4 T266M связан со сниженной инвазивностью рака». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1864 (10): 1525–1536. Дои:10.1016 / j.bbamcr.2017.06.010. PMID 28641978.
- ^ Лим М.М., Ви Дж. У., Сунг Дж. К., Чуа Д., Тан В. Р., Лизван М. и др. (Октябрь 2018 г.). «Обеспечение метаболической гибкости с помощью ангиопоэтин-подобного белка 4 повышает чувствительность метастатических раковых клеток к химиотерапевтическим препаратам». Молекулярный рак. 17 (1): 152. Дои:10.1186 / s12943-018-0904-z. ЧВК 6195749. PMID 30342537.
- ^ Чонг Х.С., Тан С.К., Хуанг Р.Л., Тан Н.С. (февраль 2012 г.). «Матрицеллюлярные белки: неприятное дело с раком». Журнал онкологии. 2012: 351089. Дои:10.1155/2012/351089. ЧВК 3306981. PMID 22481923.
- ^ Goh YY, Pal M, Chong HC, Zhu P, Tan MJ, Punugu L и др. (Декабрь 2010 г.). «Ангиопоэтин-подобный 4 взаимодействует с интегринами бета1 и бета5, чтобы модулировать миграцию кератиноцитов». Американский журнал патологии. 177 (6): 2791–803. Дои:10.2353 / ajpath.2010.100129. ЧВК 2993291. PMID 20952587.
- ^ Goh YY, Pal M, Chong HC, Zhu P, Tan MJ, Punugu L и др. (Октябрь 2010 г.). «Ангиопоэтин-подобный 4 взаимодействует с матричными белками, чтобы модулировать заживление ран». Журнал биологической химии. 285 (43): 32999–3009. Дои:10.1074 / jbc.M110.108175. ЧВК 2963335. PMID 20729546.
- ^ Chong HC, Chan JS, Goh CQ, Gounko NV, Luo B, Wang X и др. (Сентябрь 2014 г.). «Ангиопоэтин-подобный 4 стимулирует опосредованную STAT3 экспрессию iNOS и усиливает ангиогенез для ускорения заживления ран у мышей с диабетом». Молекулярная терапия. 22 (9): 1593–604. Дои:10.1038 / мт.2014.102. ЧВК 4435481. PMID 24903577.
- ^ Teo Z, Chan JS, Chong HC, Sng MK, Choo CC, Phua GZ и др. (Июль 2017 г.). «Ангиопоэтин-подобный 4 индуцирует опосредованную β-катенином повышающую регуляцию ID3 в фибробластах для снижения экспрессии коллагена в рубцах». Научные отчеты. 7 (1): 6303. Дои:10.1038 / с41598-017-05869-х. ЧВК 5524754. PMID 28740178.
- ^ Chen H, Lui YS, Tan ZW, Lee JY, Tan NS, Tan LP (май 2019 г.). «Миграция и контроль фенотипа дермальных фибробластов человека с помощью электропряденых волокнистых субстратов». Передовые медицинские материалы. 8 (9): e1801378. Дои:10.1002 / adhm.201801378. PMID 30901162.
- ^ Мусавизаде Р., Скотт А., Лу А., Ардекани Г.С., Бехзад Х., Лундгрин К. и др. (Июнь 2016). «Ангиопоэтин-подобный 4 способствует ангиогенезу в сухожилиях и увеличивается в циклически загруженных фибробластах сухожилий». Журнал физиологии. 594 (11): 2971–83. Дои:10.1113 / JP271752. ЧВК 4887665. PMID 26670924.
- ^ Бабапур-Фарроохран С., Джи К., Пухнер Б., Хассан С.Дж., Синь Х, Родригес М. и др. (Июнь 2015 г.). «Ангиопоэтин-подобный 4 - мощный ангиогенный фактор и новая терапевтическая мишень для пациентов с пролиферативной диабетической ретинопатией». Труды Национальной академии наук Соединенных Штатов Америки. 112 (23): E3030-9. Дои:10.1073 / pnas.1423765112. ЧВК 4466723. PMID 26039997.
- ^ Суконина В., Lookene A, Olivecrona T, Olivecrona G (ноябрь 2006 г.). «Ангиопоэтин-подобный белок 4 превращает липопротеинлипазу в неактивные мономеры и модулирует активность липазы в жировой ткани». Труды Национальной академии наук Соединенных Штатов Америки. 103 (46): 17450–5. Дои:10.1073 / pnas.0604026103. ЧВК 1859949. PMID 17088546.
- ^ Лафферти MJ, Брэдфорд KC, Эри Д.А., Neher SB (октябрь 2013 г.). «Ангиопоэтин-подобный белок 4 ингибирования липопротеинлипазы: свидетельство обратимого образования комплекса». Журнал биологической химии. 288 (40): 28524–34. Дои:10.1074 / jbc.M113.497602. ЧВК 3789953. PMID 23960078.
- ^ Георгиади А., Ван Й., Стиенстра Р., Тьердема Н., Янссен А., Сталенхоф А. и др. (Июль 2013). «Сверхэкспрессия ангиопоэтин-подобного белка 4 защищает от развития атеросклероза». Артериосклероз, тромбоз и биология сосудов. 33 (7): 1529–37. Дои:10.1161 / ATVBAHA.113.301698. PMID 23640487.
- ^ Георгиади А., Лихтенштейн Л., Дегенхардт Т., Бёксшотен М.В., ван Бильсен М., Десвернь Б. и др. (Июнь 2010 г.). «Индукция сердечного Angptl4 жирными кислотами с пищей опосредуется рецептором бета / дельта, активируемым пролифератором пероксисом, и защищает от окислительного стресса, вызванного жирными кислотами». Циркуляционные исследования. 106 (11): 1712–21. Дои:10.1161 / CIRCRESAHA.110.217380. PMID 20378851.
- ^ Catoire M, Alex S, Paraskevopulos N, Mattijssen F, Evers-van Gogh I, Schaart G, et al. (Март 2014 г.). «Индуцируемый жирными кислотами ANGPTL4 регулирует липидный метаболический ответ на физическую нагрузку». Труды Национальной академии наук Соединенных Штатов Америки. 111 (11): E1043-52. Дои:10.1073 / pnas.1400889111. ЧВК 3964070. PMID 24591600.
- ^ Сяо Ю.Л., Каш Дж. К., Берес С. Б., Шенг З. М., Массер Дж. М., Таубенбергер Дж. К. (март 2013 г.). «Высокопроизводительное секвенирование РНК фиксированного формалином и залитого парафином образца аутопсической ткани легкого после пандемии гриппа 1918 года». Журнал патологии. 229 (4): 535–45. Дои:10.1002 / путь.4145. ЧВК 3731037. PMID 23180419.
- ^ Ли Л., Чонг Х.С., Нг С.Ю., Квок К.В., Тео З., Тан Э.Х. и др. (Февраль 2015 г.). «Ангиопоэтин-подобный 4 увеличивает утечку и повреждение легочной ткани при гриппозной пневмонии». Отчеты по ячейкам. 10 (5): 654–663. Дои:10.1016 / j.celrep.2015.01.011. ЧВК 7185373. PMID 25660016.
- ^ Ли Л., Фу Б.Дж., Квок К.В., Сакамото Н., Мукаэ Х., Изумикава К. и др. (Июнь 2019). «Лечение антителами против ангиопоэтин-подобного 4 уменьшает отек легких и травмы при вторичной пневмококковой пневмонии». мБио. 10 (3). Дои:10,1128 / мБио.02469-18. ЧВК 6550533. PMID 31164474.
внешние ссылки
- Человек ANGPTL4 расположение генома и ANGPTL4 страница сведений о генах в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB для UniProt: Q9BY76 (Ангиопоэтин-родственный белок 4) на PDBe-KB.
дальнейшее чтение
- Алекс С., Лихтенштейн Л., Дейк В., Менсинк Р.П., Тан Н.С., Керстен С. (апрель 2014 г.). «ANGPTL4 продуцируется энтероэндокринными клетками кишечного тракта человека». Гистохимия и клеточная биология. 141 (4): 383–91. Дои:10.1007 / s00418-013-1157-y. PMID 24141811. S2CID 15092480.
- Grootaert C, Van de Wiele T, Verstraete W, Bracke M, Vanhoecke B (апрель 2012 г.). «Ангиопоэтин-подобный белок 4: влияние на здоровье, модулирующие агенты и взаимосвязь структура-функция». Экспертный обзор протеомики. 9 (2): 181–99. Дои:10.1586 / epr.12.12. PMID 22462789. S2CID 5242622.
- Терада Л.С., Нвариаку ИП (март 2011 г.). «Побег от Anoikis через ROS: ANGPTL4 управляет передачей сигналов интегрина через Nox1». Раковая клетка. 19 (3): 297–9. Дои:10.1016 / j.ccr.2011.02.019. PMID 21397852.
- Пал М., Тан MJ, Хуанг Р.Л., Го Ю.Й., Ван XL, Тан МБ, Тан Н.С. (2011). «Ангиопоэтин-подобный 4 регулирует дифференцировку эпидермиса». PLOS ONE. 6 (9): e25377. Дои:10.1371 / journal.pone.0025377. ЧВК 3178651. PMID 21966511.
- Lichtenstein L, Mattijssen F, de Wit NJ, Georgiadi A, Hooiveld GJ, van der Meer R, et al. (Декабрь 2010 г.). «Angptl4 защищает от тяжелых провоспалительных эффектов насыщенных жиров, ингибируя поглощение жирных кислот макрофагами мезентериальных лимфатических узлов». Клеточный метаболизм. 12 (6): 580–92. Дои:10.1016 / j.cmet.2010.11.002. ЧВК 3387545. PMID 21109191.
- Lichtenstein L, Berbée JF, van Dijk SJ, van Dijk KW, Bensadoun A, Kema IP, et al. (Ноябрь 2007 г.). «Angptl4 активирует синтез холестерина в печени посредством ингибирования LPL- и HL-зависимого поглощения холестерина печенью». Артериосклероз, тромбоз и биология сосудов. 27 (11): 2420–7. Дои:10.1161 / ATVBAHA.107.151894. PMID 17761937.
- Керстен С. (ноябрь 2005 г.). «Регулирование липидного обмена с помощью ангиопоэтин-подобных белков». Сделки биохимического общества. 33 (Pt 5): 1059–62. Дои:10.1042 / BST20051059. PMID 16246045.
- Ле Ян С., Эми С., Казес А., Монно С., Ламанде Н., Фавье Дж. И др. (Май 2003 г.). «Ангиопоэтин-подобный 4 представляет собой проангиогенный фактор, продуцируемый во время ишемии и при обычном почечно-клеточном раке». Американский журнал патологии. 162 (5): 1521–8. Дои:10.1016 / S0002-9440 (10) 64285-X. ЧВК 1851201. PMID 12707035.
- Мандард С., Зандберген Ф., Тан Н.С., Эшер П., Пацурис Д., Кениг В. и др. (Август 2004 г.). «Прямой рецептор, активируемый пролифератором пероксисом, нацелен на жировой фактор, индуцированный натощак (FIAF / PGAR / ANGPTL4), присутствует в плазме крови в виде усеченного белка, содержание которого увеличивается при лечении фенофибратом». Журнал биологической химии. 279 (33): 34411–20. Дои:10.1074 / jbc.M403058200. PMID 15190076.
- Xu A, Lam MC, Chan KW, Wang Y, Zhang J, Hoo RL и др. (Апрель 2005 г.). «Ангиопоэтин-подобный белок 4 снижает уровень глюкозы в крови и улучшает толерантность к глюкозе, но вызывает гиперлипидемию и стеатоз печени у мышей». Труды Национальной академии наук Соединенных Штатов Америки. 102 (17): 6086–91. Дои:10.1073 / pnas.0408452102. ЧВК 1087912. PMID 15837923.
- Герман Л. М., Пинкертон М., Дженнингс К., Ян Л., Гром А., Соудерс Д. и др. (Апрель 2005 г.). «Ангиопоэтин-подобный-4 является потенциальным ангиогенным медиатором при артрите». Клиническая иммунология. 115 (1): 93–101. Дои:10.1016 / j.clim.2004.12.002. PMID 15870027.
- Чжан Р. (апрель 2016 г.). «Модель ANGPTL3-4-8, молекулярный механизм переноса триглицеридов». Открытая биология. 6 (4): 150272. Дои:10.1098 / рсоб.150272. ЧВК 4852456. PMID 27053679.