WikiDer > Абсолютная конфигурация
An абсолютная конфигурация относится к пространственному расположению атомы из хиральный молекулярный объект (или группа) и ее стереохимический описание например р или S,[1] ссылаясь на Прямая кишка, или Зловещийсоответственно.
Абсолютные конфигурации для хиральной молекулы (в чистом виде) чаще всего получают Рентгеновская кристаллография. Все энантиомерно чистые хиральные молекулы кристаллизуются в одной из 65 Группы Sohncke (киральные пространственные группы).
Альтернативные методы оптическая вращательная дисперсия, колебательный круговой дихроизм, ультрафиолетовая и видимая спектроскопия, использование реагенты хирального сдвига в протонный ЯМР и визуализация кулоновского взрыва.[2][3]
Когда абсолютная конфигурация получена, присвоение р или S основан на Правила приоритета Кана – Ингольда – Прелога.
Абсолютные конфигурации также важны для характеристики кристаллы.
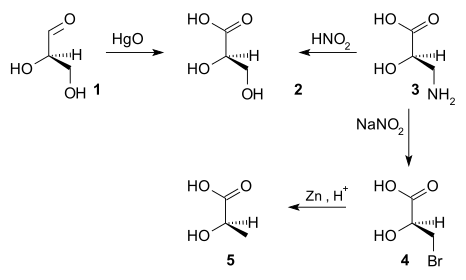
До 1951 г. невозможно было получить абсолютную конфигурацию хиральных соединений.[4] В какой-то момент было решено, что (+) -глицеральдегид был D-энантиомер.[нужна цитата] Затем конфигурация других хиральных соединений была связана с конфигурацией (+) - глицеральдегида последовательностями химические реакции. Например, окисление (+) - глицеральдегида (1) с участием оксид ртути дает (-) -глицериновая кислота (2), реакция, которая не изменяет стереоцентр. Таким образом, абсолютная конфигурация (-) - глицериновой кислоты должна быть такой же, как и у (+) - глицеральдегида. Азотная кислота[нужна цитата] окисление (+) -изосерин (3) дает (-) - глицериновую кислоту, устанавливая, что (+) - изосерин также имеет такую же абсолютную конфигурацию. (+) - Изосерин может быть преобразован двухстадийным процессом бромирования.[нужна цитата] и цинк сокращение дать (-) -молочная кислота, следовательно, (-) - молочная кислота также имеет такую же абсолютную конфигурацию. Если реакция дала энантиомер известной конфигурации, на что указывает противоположный знак оптического вращения, это будет указывать на то, что абсолютная конфигурация инвертирована.
В 1951 г. Йоханнес Мартин Бийвоет впервые используется в Рентгеновская кристаллография эффект аномальная дисперсия, который теперь называется резонансное рассеяние, чтобы определить абсолютную конфигурацию.[5] Исследуемое соединение представляло собой (+) - натрий рубидий. тартрат и из его конфигурации (р,р) был сделан вывод, что первоначальное предположение для (+) - глицеральдегида было правильным.
Конвенции
По абсолютной конфигурации: р- и S-
В R / S Система - важная номенклатурная система для обозначения энантиомеров. Этот подход маркирует каждый хиральный центр р или S в соответствии с системой, в которой каждому его заместителю назначен приоритет, согласно Правила приоритета Кана – Ингольда – Прелога (CIP) на основе атомного номера. Если центр ориентирован так, что самый низкий приоритет из четырех был направлен в сторону от зрителя, тогда зритель увидит две возможности: Если приоритет остальных трех заместителей уменьшается по часовой стрелке, он помечается р (для Прямая кишка, Латинское право), если он уменьшается против часовой стрелки, это S (для Зловещий, Латиница слева).[6]
(р) (S) написано курсивом и круглыми скобками. Если имеется несколько хиральных атомов углерода, например (1р,4S) число указывает расположение углерода перед каждой конфигурацией.[7]
В R / S система также не имеет фиксированного отношения к D / L система. Например, одна из боковых цепей серин содержит гидроксильную группу -ОН. Если заменить на нее тиоловую группу -SH, D / L маркировка, по ее определению, не будет затронута заменой. Но эта замена перевернет молекулу R / S маркировка, потому что приоритет CIP канала CH2OH ниже, чем для CO2H, но приоритет CIP канала CH2SH выше, чем для CO2H. По этой причине D / L Система по-прежнему широко используется в определенных областях биохимии, таких как химия аминокислот и углеводов, потому что удобно иметь одну и ту же хиральную метку для обычно встречающихся структур данного типа структуры у высших организмов. в D / L системы, они почти все согласованы - все встречающиеся в природе аминокислоты L, в то время как естественные углеводы почти все D. в R / S системы, они в основном S, но есть некоторые общие исключения.
Оптическим вращением: (+) - и (-) - или d- и l-
Энантиомер можно назвать по направлению, в котором он вращает плоскость поляризованного света. Вращение по часовой стрелке света, идущего к зрителю, обозначено (+) энантиомером. Его зеркальное отображение обозначено (-). (+) И (-) изомеры также были названы d- и l- (для правовращающий и левовращающий); Но, называя d- и l- легко спутать с D- и L- маркировка и поэтому не приветствуется ИЮПАК.[8]
По относительной конфигурации: D- и L-
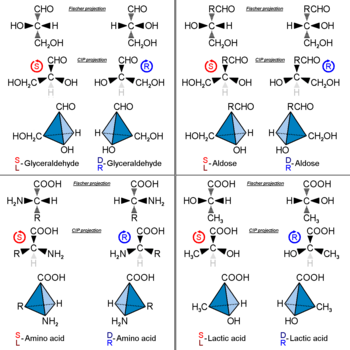
Оптический изомер можно назвать пространственной конфигурацией его атомов. В D / L система (названная в честь латинских dexter и laevus, справа и слева), не путать с d- и l-система см. выше, делает это, связывая молекулу с глицеральдегид. Глицеральдегид сам по себе хиральный, и два его изомера помечены D и L (обычно набирается в маленькие шапки в опубликованной работе). Некоторые химические манипуляции могут быть выполнены с глицеральдегидом, не влияя на его конфигурацию, и его историческое использование для этой цели (возможно, в сочетании с его удобством как одной из самых маленьких обычно используемых хиральных молекул) привело к его использованию для номенклатуры. В этой системе соединения названы по аналогии с глицеральдегидом, который, как правило, дает однозначные обозначения, но его легче всего увидеть в небольших биомолекулах, подобных глицеральдегиду. Одним из примеров является хиральная аминокислота аланин, который имеет два оптических изомера, и они помечены в соответствии с изомером глицеральдегида, из которого они происходят. С другой стороны, глицин, аминокислота, полученная из глицеральдегида, не обладает оптической активностью, так как не является хиральной (ахиральной).
В D / L маркировка не имеет отношения к (+) / (-); он не указывает, какой энантиомер является правовращающим, а какой - левовращающим. Скорее, это указывает на стереохимию соединения относительно стереохимии правовращающий или левовращающий энантиомер глицеральдегида. Правовращающий изомер глицеральдегида, по сути, является D- изомер. Девять из девятнадцати L-аминокислоты, обычно присутствующие в белках, являются правовращающими (при длине волны 589 нм), и D-фруктоза также называется левулозой, потому что она обладает левовращающим действием. Эмпирическое правило для определения D / L изомерная форма аминокислоты - это правило «КУКУРУЗЫ». Группы:
- COОЙ, р, NЧАС2 и H (где R - боковая цепь)
расположены вокруг атома углерода хирального центра. С атомом водорода вдали от зрителя, если расположение CO→р→N группы вокруг атома углерода, поскольку центр находится против часовой стрелки, то это L форма.[9] Если расположение по часовой стрелке, это D форма. Как обычно, если сама молекула ориентирована иначе, например, H по направлению к наблюдателю, картина может быть обратной. В L форма обычная, найденная в натуральных белках. Для большинства аминокислот L форма соответствует S абсолютная стереохимия, но р вместо этого для определенных боковых цепей.
Смотрите также
использованная литература
- ^ ИЮПАК, Сборник химической терминологии2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "абсолютная конфигурация". Дои:10.1351 / goldbook.A00020
- ^ http://www.mpg.de/7634710/coulomb-explosion-method
- ^ http://atom.uni-frankfurt.de/research/laser/2_molecules/Stereochemistry/
- ^ Органическая химия (4-е издание) Паула Ю. Брюс
- ^ Определение абсолютной конфигурации оптически активных соединений с помощью рентгеновских лучей Nature 168, 271-272 J. M. BIJVOET, A. F. PEERDEMAN & A. J. van BOMMEL Дои:10.1038 / 168271a0
- ^ Эндрю Штрейтвизер & Клейтон Х. Хиткок (1985). Введение в органическую химию (3-е изд.). Издательская компания Macmillan.
- ^ Кляйн, Дэвид Р. (31 декабря 2013 г.). Органическая химия (2-е изд.). Вайли. п. 208. ISBN 978-1118454312.
- ^ Г.П. Мох:Базовая терминология стереохимии (Рекомендации 1996 г.); Pure Appl. Chem., 1996, т. 68, № 12, с. 2205; Дои:10.1351 / pac199668122193
- ^ «Номенклатура и символика аминокислот и пептидов». Чистое приложение Chem. 56 (5): 595–624. 1984. Дои:10.1351 / pac198456050595.