WikiDer > Стереохимия
Стереохимия, субдисциплина химия, предполагает изучение относительного пространственного расположения атомы которые образуют структуру молекулы и их манипуляции.[1] Изучение стереохимии фокусируется на стереоизомеры, которые по определению имеют одинаковую молекулярную формулу и последовательность связанных атомов (строение), но различаются трехмерной ориентацией своих атомов в пространстве. По этой причине он также известен как 3D химия - приставка «стерео-» означает «трехмерность».[2]
Важным разделом стереохимии является изучение хиральный молекулы.[3] Стереохимия охватывает весь спектр органический, неорганический, биологический, физический и особенно супрамолекулярная химия. Стереохимия включает методы определения и описания этих отношений; влияние на физический или же биологический свойства, которые эти отношения придают рассматриваемым молекулам, и то, каким образом эти отношения влияют на реакционную способность рассматриваемых молекул (динамическая стереохимия).
История
Луи Пастер можно по праву назвать первым стереохимиком, заметившим в 1842 г., что соли из Винная кислота собрано из вино производственные суда могли вращать самолет поляризованный свет, но соли из других источников - нет. Это свойство, единственное физическое свойство, которым различались два типа солей винной кислоты, обусловлено: оптическая изомерия. В 1874 г. Якобус Хенрикус ван 'т Хофф и Джозеф Ле Бель объяснил оптическую активность тетраэдрическим расположением атомов, связанных с углеродом. Кекуле использовал тетраэдрические модели ранее в 1862 году, но никогда не публиковал их; Эмануэле Патерно, вероятно, знал об этом, но он был первым, кто нарисовал и обсудил трехмерные структуры, такие как 1,2-дибромэтан в Gazetta Chimica Italiana в 1893 г.[4]
Значимость
Правила приоритета Кана – Ингольда – Прелога являются частью системы описания стереохимии молекулы. Они стандартным образом ранжируют атомы вокруг стереоцентра, позволяя однозначно описать относительное положение этих атомов в молекуле. А Проекция Фишера это упрощенный способ изобразить стереохимию вокруг стереоцентра.
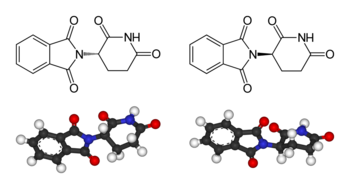
Пример талидомида
Часто цитируемый пример важности стереохимии связан с катастрофой с талидомидом. Талидомид это фармацевтический препарат, впервые приготовленный в 1957 году в Германии, прописан для лечения утреннего недомогания беременных женщин. Было обнаружено, что препарат тератогенный, вызывая серьезные генетический повреждение раннего эмбрионального роста и развития, приводящее к деформации конечностей у младенцев. Некоторые из предложенных механизмы тератогенности включают другую биологическую функцию для (р) - и (S) энантиомеры талидомида.[5] Однако в организме человека талидомид подвергается рацемизация: даже если только один из двух энантиомеров вводится как лекарство, другой энантиомер образуется в результате метаболизма.[6] Соответственно, неверно утверждать, что один стереоизомер безопасен, а другой - тератогенный.[7] Талидомид в настоящее время используется для лечения других заболеваний, особенно рака и проказа. Были введены строгие правила и меры контроля, чтобы избежать его использования беременными женщинами и предотвратить деформации развития. Эта катастрофа стала движущей силой, заставившей требовать строгого тестирования лекарств, прежде чем они станут общедоступными.
Определения
Множество определений, описывающих конкретный конформер (Золотая книга ИЮПАК) существуют, разработан Уильям Клайн и Владимир Прелог, составляющие их Система Клайна – Прелога номенклатуры:
- а угол кручения ± 60 ° называется бестактный[8]
- угол кручения от 0 ° до ± 90 ° называется син (s)
- угол кручения от ± 90 ° до 180 ° называется анти (а)
- угол кручения от 30 ° до 150 ° или от -30 ° до -150 ° называется клинальный
- угол кручения от 0 ° до 30 ° или от 150 ° до 180 ° называется перипланарный (п)
- угол кручения от 0 ° до 30 ° называется синперипланарный или же син- или же цис-конформация (sp)
- угол кручения от 30 ° до 90 ° и от –30 ° до –90 ° называется синклинальный или же бестактный или же перекос (сбн)[9]
- угол кручения от 90 ° до 150 ° и от –90 ° до –150 ° называется антиклинальный (ac)
- угол кручения от ± 150 ° до 180 ° называется антиперипланарный или же анти или же транс (ап).
Деформация кручения возникает из-за сопротивления скручиванию связи.
Типы
Смотрите также
| В Wikiquote есть цитаты, связанные с: Стереохимия |
- Стереохимия алканов
- Хиральное разрешение, который часто включает кристаллизацию
- Хиральность (химия) (Р / С, д / л)
- Химия твердого тела
- Теория VSEPR
- Формула скелета # Стереохимия который описывает, как стереохимия обозначается в скелетных формулах.
Рекомендации
- ^ Эрнест Элиэль Основы органической стереохимии ,2001 ISBN 0471374997; Бернард Теста и Джон Колдуэлл Органическая стереохимия: руководящие принципы и биомедицинская значимость 2014 ISBN 3906390691; Хуа-Цзе Чжу Органическая стереохимия: экспериментальные и вычислительные методы 2015 ISBN 3527338225; Ласло Поппе, Михай Ногради, Йожеф Надь, Габор Хорнянски, Золтан Борос Стереохимия и стереоселективный синтез: введение 2016 ISBN 3527339019
- ^ "определение стерео-". Dictionary.com. В архиве из оригинала от 09.06.2010.
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Роберто Зингалес Chem. Europ. Дж. 2009, 15, 7760 https://onlinelibrary.wiley.com/doi/epdf/10.1002/chem.200900200
- ^ Стивенс Т.Д., Бунде С.Дж., Филлмор Б.Дж. (июнь 2000 г.). «Механизм действия в тератогенезе талидомида». Биохимическая фармакология. 59 (12): 1489–99. Дои:10.1016 / S0006-2952 (99) 00388-3. PMID 10799645.
- ^ Тео С.К., Колберн В.А., Трейсвелл В.Г., Кук К.А., Стирлинг Д.И., Яворски М.С., Шеффлер М.А., Томас С.Д., Ласкин О.Л. (2004). «Клиническая фармакокинетика талидомида». Clin. Фармакокинет. 43 (5): 311–327. Дои:10.2165/00003088-200443050-00004. PMID 15080764. S2CID 37728304.
- ^ Франк, Мишель (2010). «Городские легенды химии». Химия природы. 2 (8): 600–601. Bibcode:2010НатЧ ... 2..600F. Дои:10.1038 / nchem.750. PMID 20651711.
- ^ Анслин, Эрик В. и Догерти, Деннис А. Современная физико-органическая химия. University Science (15 июля 2005 г.), 1083 с. ISBN 1-891389-31-9
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "бестактный". Дои:10.1351 / goldbook.G02593