WikiDer > Арин
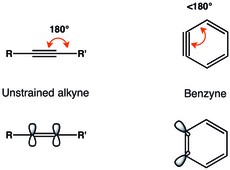
Арынес[1] или же бензины[2] являются высокореактивными видами, происходящими из ароматическое кольцо устранением двух заместители. Наиболее распространены арины орто но также известны мета- и пара-арины.[3][4][5] о-Arynes - примеры напряженного алкины.
Связь в о-arynes
Алкиновое представление бензина является наиболее распространенным. о-Арины или 1,2-дидегидроарены обычно описываются как имеющие натянутую тройную связь.[6]
Геометрические ограничения на тройную связь в орто-бензин приводит к уменьшению перекрытия р-орбиталей в плоскости и, следовательно, к более слабой тройной связи.[7] Частота колебаний тройной связи в бензине была определена Радзишевским равной 1846 см.−1,[8] что указывает на более слабую тройную связь, чем в недеформированном алкине с частотой колебаний приблизительно 2150 см−1. Тем не менее, орто-бензин больше похож на деформированный алкин, чем на бирадикал, как видно из большого синглет-триплетного промежутка и алкиноподобной реакционной способности.[3]
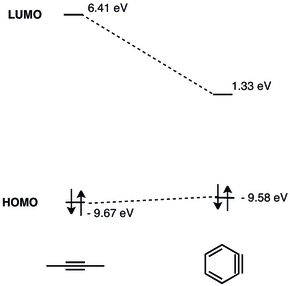
В LUMO Арина находится намного ниже, чем НСМО недеформированных алкинов, что делает его более подходящим по энергии для ВЗМО нуклеофилов. Следовательно, бензин обладает электрофильным характером и вступает в реакции с нуклеофилами.[9] Подробный МО-анализ бензина был представлен в 1968 г.[10]
Генерация о-arynes
Из-за их чрезвычайной реакционной способности арины должны образовываться. на месте. Типичный для других реактивные промежуточные продукты, бензин должен улавливаться, иначе он димерисы к бифенилен.
Ранние пути к бензину вовлечены дегидрогалогенирование из арилгалогениды:
Такие реакции требуют сильного основания и высоких температур. Орто-дизамещенные арены служат предшественниками бензинов в более мягких условиях. Бензин образуется при дегалогенировании 2-бромфторбензола магнием.[11] Антраниловая кислота может быть превращен в 2-диазониобензол-1-карбоксилат путем диазотирования и нейтрализации. Хотя взрывоопасно,[12] это цвиттерионный разновидность - удобный и недорогой предшественник бензина.[13]
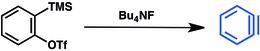
Другой метод основан на использовании триметилсилиларила. трифлаты.[14] Замещение фторидом триметилсилильной группы индуцирует удаление трифлата и высвобождение бензина:
А гексадегидро реакция Дильса-Альдера (HDDA) включает циклоприсоединение 1,3-диина и алкина.[15]
N-минирование 1ЧАС-бензотриазол с гидроксиламинО-сульфоновая кислота образует промежуточное соединение, которое может быть окислено до бензина с почти количественным выходом с свинец (IV) ацетат.[16]
Реакции о-arynes
Даже при низких температурах арины чрезвычайно реактивны. Их реакционную способность можно разделить на три основных класса: (1) нуклеофильные присоединения, (2) перициклические реакции и (3) вставки связей.
Нуклеофильные добавки к аринам
После обработки основными нуклеофилами арилгалогениды депротонируют альфа до уходящей группы, что приводит к дегидрогалогенирование. Исследования изотопного обмена показывают, что для арилфторидов и, иногда, арилхлоридов, элиминирование происходит в два этапа: депротонирование с последующим изгнанием нуклеофила. Таким образом, процесс формально аналогичен механизму E1cb алифатических соединений. С другой стороны, арилбромиды и йодиды, как правило, подвергаются элиминации с помощью согласованного синкопланарного механизма E2.[17][18] Образующийся бензин образует продукты присоединения, обычно путем нуклеофильного присоединения и протонирования. Образование промежуточного бензина - медленная стадия реакции.[19]
Реакции "аринового сочетания" позволяют получать бифенильные соединения, которые ценны в фармацевтической промышленности, сельском хозяйстве и в качестве лигандов во многих превращениях, катализируемых металлами.[20]
Продукт металл-арен может также присоединяться к другому арину, что приводит к полимеризация с ростом цепи. С помощью цианид меди (I) в качестве инициатора для добавления к первому арину получали полимеры, содержащие примерно до 100 ареновых звеньев.[21]
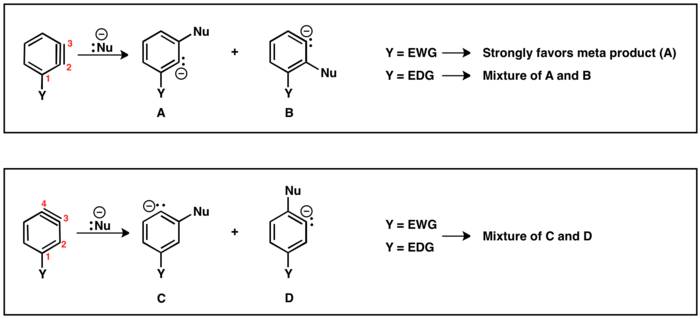
Когда уходящая группа (LG) и заместитель (Y) являются взаимно орто или пара, возможно только одно промежуточное бензин. Однако, когда LG является мета-Y, тогда возможны региохимические исходы (A и B). Если Y электроноакцепторный, то HB более кислый, чем HА в результате образуется региоизомер B. Аналогично, если Y электронодонорный, образуется региоизомер A, так как теперь HА это более кислый протон.
Существует два возможных региоизомера бензина с заместителем (Y): тройная связь может располагаться между C2 и C3 или между C3 и C4. Заместители в орто-положении по отношению к уходящей группе приведут к тройной связи между C2 и C3. Para Y и LG приведут к региоизомеру с тройной связью между C3 и C4. Мета-заместитель может давать оба региоизомера, как описано выше. В случае тройной связи, расположенной между C2 и C3, электроноакцепторные (EWG) заместители, например CF3 будет направлять добавление нуклеофила, чтобы разместить карбанион как можно ближе к EWG. Однако электронодонорные (EDG) заместители, например CH3 будет обеспечивать небольшую селективность между продуктами. В региоизомере, где тройная связь расположена между C3 и C4, влияние заместителя на присоединение нуклеофила уменьшается, и часто получаются смеси пара- и мета-продуктов.[19]
Перициклические реакции аринов
Бензин подвергается быстрой димеризации с образованием бифенилена. Некоторые пути получения бензина приводят к особенно быстрому и высокому выходу этой последующей реакции.[13][16] Тримеризация дает трифенилен.[22]
Бензины могут пройти [4+2] реакции циклизации. Когда генерируется в присутствии антрацен, триптицен полученные результаты.[11] В этом методе согласованный механизм реакции Дильса-Альдера между бензином и фураном показан ниже. Считается, что другие бензин [4 + 2] циклоприсоединения протекают по ступенчатому механизму.
Классический пример - синтез 1,2,3,4-тетрафенилнафталин.[23] Тетрабромбензол может реагировать с бутиллитий и фуран с образованием тетрагидроантрацена[24]
[4 + 2] циклоприсоединения аринов обычно применялись для полного синтеза природных продуктов. Однако основным ограничением такого подхода является необходимость использования связанных диенов, таких как фуран и циклопентадиен.[14] В 2009 году Бушек и его сотрудники синтезировали гербиндол А с использованием арин [4 + 2] -циклоприсоединения.[25] 6,7-индолин претерпевает [4 + 2] циклоприсоединение с циклопентадиеном с образованием сложного тетрациклического продукта.
Бензины подвергаются [2 + 2] циклоприсоединению с широким спектром алкенов. Из-за электрофильной природы бензина алкены, содержащие электронодонорные заместители, лучше всего подходят для этой реакции.[26]
Из-за образования значительных побочных продуктов химия [2 + 2] арина редко используется в полном синтезе природных продуктов.[14] Тем не менее, есть несколько примеров. В 1982 году Стивенс и его коллеги сообщили о синтезе таксодиона, в котором используется [2 + 2] циклоприсоединение между арином и кетенацеталем.[27]
Мори и соавторы выполнили катализируемую палладием [2 + 2 + 2] -коциклизацию арина и диина в своем полном синтезе тайванинов C.[28]
Связующие реакции аринов
Первым примером реакции вставки σ-связи арина является синтез меллена в 1973 году.[29]
Прочие дегидробензолы
Если бензин представляет собой 1,2-дидегидробензол, возможны еще два изомера: 1,3-дидегидробензол и 1,4-дидегидробензол.[3] Их энергия in silico составляют соответственно 106, 122 и 138 ккал / моль (444, 510 и 577 кДж / моль).[30] 1,2- и 1,3-изомеры имеют синглетные основные состояния, тогда как для 1,4-бензина щель меньше.
Изучено взаимное превращение 1,2-, 1,3- и 1,4-дидегидробензолов.[30][31] Предполагается, что превращение 1,2- в 1,3-дидегидробензол происходит в пиролиз (900 ° C) фенил замещенные предшественники арина[30] как показано ниже. Для взаимного превращения бензина требуются чрезвычайно высокие температуры.
1,4-дидегидроарены
В классических экспериментах с 1,4-дидегидробензолом при нагревании до 300 ° C [1,6-D2] -А легко уравновешивается с [3,2-D2] -B, но не уравновешивается C или же D. Одновременная миграция атомов дейтерия с образованием B, и тот факт, что ни один из C или же D может быть объяснено только наличием циклического симметричного интермедиата - 1,4-дидегидробензола.[32]
Для 1,4-дидегидробензола предложено два состояния: синглетное и триплетное, причем синглетное состояние ниже по энергии.[33][34] Триплетное состояние представляет два невзаимодействующих радикальных центра и, следовательно, должно отводить водород с той же скоростью, что и фенильный радикал. Однако синглетное состояние более стабилизировано, чем триплетное, и поэтому некоторая часть стабилизирующей энергии будет потеряна, чтобы сформировать переходное состояние для расщепления водорода, что приведет к более медленному отрыву водорода. Чен предложил использовать аналоги 1,4-дидегидробензола, которые имеют большие синглет-триплетные энергетические щели для повышения селективности кандидатов в ендииновые лекарственные средства.[35]
История
Первые доказательства наличия аринеса были получены в работах Штёрмера и Калерта. В 1902 году они наблюдали, что при обработке 3-бромбензофурана основанием в этаноле образуется 2-этоксибензофуран. На основании этого наблюдения они постулировали промежуточный арин.[36]
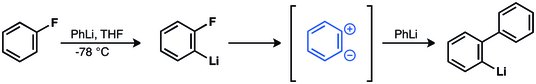
Виттиг и другие. вызывает цвиттерионный промежуточный продукт в реакции фторбензола и фениллития с образованием бифенила.[37][38][39] Позднее эта гипотеза подтвердилась.[40][41][42][43][44]
В 1953 г. 14Эксперименты по мечению C убедительно подтвердили промежуточное действие бензина.[40] Джон Д. Робертс и другие. показали, что реакция хлорбензола-1-14C и амид калия дали равные количества анилина с 14Включение C в C-1 и C-2.
Виттиг и Похмер обнаружили, что бензин участвует в реакциях [4 + 2] циклоприсоединения.[45]
Дополнительные доказательства существования бензина были получены в результате спектроскопических исследований.[3] Бензин был обнаружен в «молекулярном контейнере».[46]
В 2015 году одна молекула арина была сфотографирована СТМ.[47]
м-Бензин был впервые продемонстрирован в 1990-х годах, когда он был получен из 1,3-дизамещенных производных бензола, таких как пероксиэфир 1,3-C6ЧАС4(O2C (O) CH3)2.[3]
Прорывы на п-бензины появились в 1960-х годах, следуя исследованиям Циклизация Бергмана.[32] Эта тема стала актуальной с открытием эндииновых «цитостатиков», таких как калихеамицин, который образует 1,4-дидегидробензол.[48]
Примеры бензинов в полном синтезе
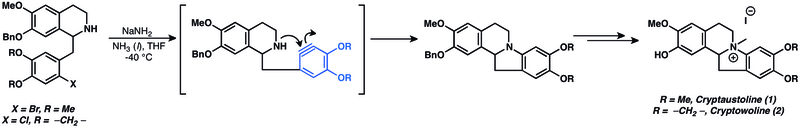
Были приготовлены разнообразные натуральные продукты с использованием аринов в качестве промежуточных продуктов.[14] Нуклеофильные добавки к аринам широко используются в полном синтезе природных продуктов. Действительно, нуклеофильные добавки аринов являются одними из старейших известных приложений химии аринов.[14] Нуклеофильное присоединение к арину было использовано при попытке синтеза криптаустолина (1) и криптоволина (2).[49]
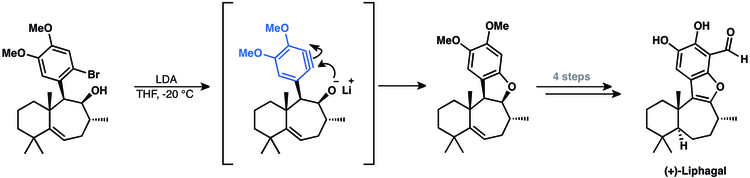
В синтезе тетрациклического меротерпеноида (+) - липагала участвует промежуточный арин.[50] В их подходе использовалась циклизация арина для замыкания последнего кольца натурального продукта.[14]
Многокомпонентные реакции аринов представляют собой мощные превращения, которые позволяют быстро образовывать 1,2-дизамещенные арены. Несмотря на их потенциальную полезность, примеры реакций многокомпонентных аринов в синтезе природных продуктов немногочисленны.[14] Четырехкомпонентная реакция сочетания арина была использована в синтезе дегидроальтенуола B.[51]
Смотрите также
- Еще примеры использования химии арина: трициклобутабензол, ин-метилциклофан, Бензиновый комплекс переходного металла
- Пиридиновый эквивалент пиридин
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Арин". Дои:10.1351 / goldbook.A00465
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Бензины". Дои:10.1351 / goldbook.B00634
- ^ а б c d е Ханс Хеннинг Венк, Майкл Винклер, Вольфрам Сандер (2003). «Один век химии арин». Энгью. Chem. Int. Эд. 42 (5): 502–528. Дои:10.1002 / anie.200390151. PMID 12569480.CS1 maint: использует параметр авторов (связь)
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Дегидроарены". Дои:10.1351 / goldbook.D01574
- ^ ИЮПАК Золотая книга запись для "бензинов" определяет "м-бензин "а"п-бензин »как ошибочные термины для 1,3- и 1,4-дидегидробензола
- ^ Anslyn, E. V .; Догерти, Д. А .: Современная физико-органическая химия, University Science Books, 2006, стр. 612.
- ^ Gampe, C.M .; Каррейра, Э. М. (2012). «Арины и циклогексин в синтезе природных продуктов». Энгью. Chem. Int. Эд. Англ.. 51 (16): 3766–78. Дои:10.1002 / anie.201107485. PMID 22422638.CS1 maint: использует параметр авторов (связь)
- ^ Radziszewski, J. G .; Hess, Jr. B.A .; Заградник, Р. (1992). «Инфракрасный спектр о-бензина: эксперимент и теория». Варенье. Chem. Soc. 114: 52. Дои:10.1021 / ja00027a007.CS1 maint: использует параметр авторов (связь)
- ^ Гилкрист, Т. Л. Дополнение C: Химия функциональных групп с тройными связями, часть 1. Patai, S .; Rappaport, Z. Eds., John Wiley & Sons, Нью-Йорк, 1983.
- ^ Hoffmann, R .; Имамура, А .; Хере, В. Дж. (1968). «Бензины, дегидроконъюгированные молекулы и взаимодействие орбиталей, разделенных рядом промежуточных сигма-связей». Варенье. Chem. Soc. 90 (6): 1499. Дои:10.1021 / ja01008a018.
- ^ а б Виттиг, Георг (1959). «Триптицен». Орг. Синтезатор. 39: 75. Дои:10.15227 / orgsyn.039.0075.
- ^ Салливан, Джон М. (1971-06-01). «Взрыв при получении гидрохлорида бензолдиазония-2-карбоксилата». Журнал химического образования. 48 (6): 419. Bibcode:1971JChEd..48..419S. Дои:10.1021 / ed048p419.3. ISSN 0021-9584.
- ^ а б Логулло, Фрэнсис М .; Зейтц, Арнольд М .; Фридман, Лестер (1968). «Бензолдиазониум-2-карбоксилат и бифенилен (Benzenediazonium, о-карбокси-, гидроксид, внутренняя соль) ». Орг. Синтезатор. 48: 12. Дои:10.15227 / orgsyn.048.0012.
- ^ а б c d е ж грамм Tadross, P.M .; Штольц, Б. М. (2012). «Всеобъемлющая история аринов в полном синтезе природных продуктов». Chem. Rev. 112 (6): 3550–3577. Дои:10.1021 / cr200478h. PMID 22443517.CS1 maint: использует параметр авторов (связь)
- ^ Hoye, T. R .; Baire, B .; Niu, D .; Уиллоуби, П. Х .; Вудс, Б. П. (2012). «Гексадегидро-реакция Дильса – Альдера». Природа. 490 (7419): 208. Bibcode:2012Натура.490..208H. Дои:10.1038 / природа11518. ЧВК 3538845. PMID 23060191.
- ^ а б Campbell, C.D .; К. В. Рис (1969). «Реакционные промежуточные соединения. Часть I. Синтез и окисление 1- и 2-аминобензотриазола». J. Chem. Soc. C. 1969 (5): 742–747. Дои:10.1039 / J39690000742.
- ^ Панар, Мануэль (1961). Механизм исключения-добавления нуклеофильного ароматического замещения. Пасадена, Калифорния: Калифорнийский технологический институт (докторская диссертация). С. 4–5.
- ^ Х., Лоури, Томас (1987). Механизм и теория в органической химии. Ричардсон, Кэтлин Шюллер (3-е изд.). Нью-Йорк: Харпер и Роу. стр.643. ISBN 0060440848. OCLC 14214254.
- ^ а б Anslyn, E. V .; Догерти, Д.А. Современная физико-органическая химия. Книги университетских наук, 2006
- ^ Diemer, V .; Бегаут, М .; Leroux, F. R .; Колоберт, Ф. Евро. J. Org. Chem. 2011, 341
- ^ Мизукоши, Ёсихидэ; Миками, Коитиро; Учияма, Масанобу (2015). «Полимеризация арина, позволяющая прямой синтез неуловимых поли (орто-арилен) s ». Варенье. Chem. Soc. 137 (1): 74–77. Дои:10.1021 / ja5112207. PMID 25459083.
- ^ Heaney, H .; Миллар, И. Т. (1960). «Трифенилен». Органический синтез. 40: 105.; Коллективный объем, 5, 1973, с. 1120
- ^ «1,2,3,4-Тетрафенилнафталин». Органический синтез. 46: 107. 1966. Дои:10.15227 / orgsyn.046.0107.
- ^ «Использование 1,2,4,5-тетрабромбензола в качестве 1,4-нензадинового эквивалента: анти- и син-1,4,5,8-тетрагидроантрацен 1,4: 5,8-диэпоксиды». Органический синтез. 75: 201. 1998. Дои:10.15227 / orgsyn.075.0201.
- ^ Buszek, K. R .; Brown, N .; Куо, Д. (2009). «Краткий полный синтез (±) -цис-трикентрина А и (±) -гербиндола А посредством межмолекулярного циклоприсоединения индола арина». Орг. Латыш. 11: 201. Дои:10.1021 / ol802425m. ЧВК 2723800. PMID 19055375.
- ^ Pellissier, H .; Сантелли, М. Тетраэдр, 2003; 59, 701
- ^ Stevens, R. V .; Бисакки, Г.С. J. Org, Chem. 1982; 47, 2396
- ^ Sato, Y .; Тамура, Т .; Мори, М. Энгью. Chem. Int. Эд. 2004; 43, 2436
- ^ Guyot, M .; Молхо, Д. Tetrahedron Lett. 1973; 14, 3433
- ^ а б c Blake, M.E .; Bartlett, K. L .; Джонс, М. младший (2003). «Превращение м-бензина в о-бензин посредством 1,2-сдвига фенильной группы». Варенье. Chem. Soc. 125 (21): 6485–90. Дои:10.1021 / ja0213672. PMID 12785789.
- ^ Полищук, А.Л .; Bartlett, K. L .; Фридман, Л. А .; Джонс, М. младший (2004). «Превращение п-бензина в м-бензин посредством 1,2-сдвига фенильной группы. Завершение бензинового каскада». J. Phys. Орг. Chem. 17 (9): 798–806. Дои:10.1002 / poc.797.
- ^ а б Ричард Р. Джонс; Роберт Г. Бергман (1972). «п-Бензин. Образование в качестве промежуточного продукта в реакции термической изомеризации и улавливание свидетельств 1,4-бензолдиильной структуры». Варенье. Chem. Soc. 94 (2): 660–661. Дои:10.1021 / ja00757a071.
- ^ Clauberg, H .; Минсек, Д. В .; Чен П. (1992). «Масс-спектроскопия и фотоэлектронная спектроскопия C3H2. .DELTA.Hf синглетных карбенов отклоняются от аддитивности из-за их синглет-триплетных щелей». Варенье. Chem. Soc. 114: 99. Дои:10.1021 / ja00027a014.
- ^ Blush, J. A .; Clauberg, H .; Кон, Д. В .; Минсек, Д. В .; Чжан, X .; Чен, П. (1992). «Фотоионизационная масс- и фотоэлектронная спектроскопия радикалов, карбенов и бирадикалов». Соотв. Chem. Res. 25 (9): 385. Дои:10.1021 / ar00021a001.
- ^ Чен, П. (1996). «Разработка агентов для отвода водорода на основе бирадикалов». Энгью. Chem. Int. Эд. Англ.. 35 (1314): 1478. Дои:10.1002 / anie.199614781.
- ^ Stoermer, R .; Калерт, Б. (1902). "Ueber das 1- und 2-Brom-cumaron". Berichte der Deutschen Chemischen Gesellschaft. 35 (2): 1633–1640. Дои:10.1002 / cber.19020350286.
- ^ Wittig, G .; Pieper, G .; Фурманн, Г. (1940). "Uber die Bildung von Diphenyl aus Fluorbenzol und Phenyl-lithium (IV. Mitteil. Über Austauschreaktionen mit Phenyl-lithium)". Berichte der Deutschen Chemischen Gesellschaft (серии A и B). 73 (11): 1193–1197. Дои:10.1002 / cber.19400731113.
- ^ Виттиг, Георг (1942). "Phenyl-lithium, der Schlüssel zu einer neuen Chemie Metallorganischer Verbindungen". Die Naturwissenschaften. 30 (46–47): 696–703. Дои:10.1007 / BF01489519.
- ^ Виттиг, G (1954). "Fortschritte auf dem Gebiet der organischen Aniono-Chemie". Angewandte Chemie. 66: 10–17. Дои:10.1002 / ange.19540660103.
- ^ а б Робертс, Джон Д. (1953). «Перегруппировка в реакции хлорбензол-1-C14 с амидом калия1». Журнал Американского химического общества. 75 (13): 3290–3291. Дои:10.1021 / ja01109a523.
- ^ Робертс, Джон Д. (1956). «Механизм аминов галобензолов 1». Журнал Американского химического общества. 78 (3): 601–611. Дои:10.1021 / ja01584a024.
- ^ Робертс, Джон Д. (1956). «Ориентация в аминированиях замещенных галобензолов 1». Журнал Американского химического общества. 78 (3): 611–614. Дои:10.1021 / ja01584a025.
- ^ Современные методы арилирования. Под редакцией Лутца Акерманна, 2009 г., WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN 978-3-527-31937-4
- ^ Хини, Х. (1962). «Бензин и родственные промежуточные продукты». Химические обзоры. 62 (2): 81–97. Дои:10.1021 / cr60216a001.
- ^ Wittig, G .; Похмер, Л. Энгью. Chem. 1955; 67(13), 348.
- ^ Warmuth, R .; Юн (2001). «Последние достижения в области гемикарко-химии». Соотв. Chem. Res. 34 (2): 96. Дои:10.1021 / ar980082k. PMID 11263868.
- ^ На поверхности; Перес, Э. Гитян; Пенья, Л. Гросс (2015). «На поверхности генерации и визуализации аринов с помощью атомно-силовой микроскопии». Химия природы. 7 (8): 623–8. Bibcode:2015НатЧ ... 7..623П. Дои:10.1038 / нхим.2300. PMID 26201737.
- ^ Галм, У; Hager, MH; Ван Ланен, С. Г.; Джу, Дж; Торсон, Дж. С.; Шен, Б. (февраль 2005 г.). «Противоопухолевые антибиотики: блеомицин, ендиины, митомицин». Химические обзоры. 105 (2): 739–58. Дои:10.1021 / cr030117g. PMID 15700963.
- ^ Каметани, Т .; Огасавара, К. Дж. J. Chem. Soc., C 1967, 2208
- ^ Day, J. J .; McFadden, R.M .; Virgil, S.C .; Колдинг, H .; Alleva, J. L .; Штольц, Б. М. (2011). «Каталитический энантиоселективный тотальный синтез (+) - липагала». Энгью. Chem. Int. Эд. 50 (30): 6814–8. Дои:10.1002 / anie.201101842. ЧВК 3361906. PMID 21671325.
- ^ Соорукрам, Д .; Qu, T .; Барретт, А. Г. М. (2008). «Реакции четырехкомпонентного бензинового связывания: краткий полный синтез дегидроальтенуола B». Орг. Латыш. 10 (17): 3833–3835. Дои:10.1021 / ol8015435. PMID 18672878.CS1 maint: использует параметр авторов (связь)
внешняя ссылка
 СМИ, связанные с Арынес в Wikimedia Commons
СМИ, связанные с Арынес в Wikimedia Commons