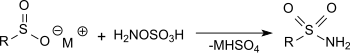WikiDer > Гидроксиламин-O-сульфоновая кислота
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.019.065 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| ЧАС3NО4S | |
| Молярная масса | 113.09 |
| Внешность | белое твердое вещество |
| Температура плавления | 210 ° С |
| холодная вода | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
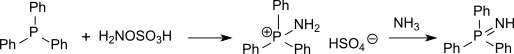
Гидроксиламин-О-сульфоновая кислота ("HOSA") это неорганическое соединение с молекулярная формула ЧАС3НЕТ4S, который образуется при сульфировании гидроксиламин с олеум.[1] Это белый, водорастворимый и гигроскопичный, твердые, обычно представленные сжатая структурная формула ЧАС2NOSO3H, хотя на самом деле он существует как цвиттерион[2] и поэтому более точно представляется как +ЧАС3NOSO3−. Он используется как реагент для введения аминогрупп (–NH2), для преобразования альдегиды в нитрилы и алициклический кетоны в лактамы (циклический амиды), а также для синтеза различных азотсодержащих гетероциклов.[2][3][4]
Подготовка
По лабораторной методике[1] гидроксиламинО-сульфоновая кислота может быть получена путем обработки сульфат гидроксиламина с дымом серная кислота (олеум). Производственный процесс аналогичен.[5]
- (NH3ОЙ)2ТАК4 + 2SO3 → 2H2NOSO3H + H2ТАК4
Сульфирование гидроксиламина также можно проводить с хлорсульфоновая кислота[2] методом, впервые опубликованным в 1925 г.[6] и усовершенствован для Органический синтез.[7]
Структура
Аналогично сульфаминовая кислота (ЧАС3N+ТАК3−) и, как это обычно бывает с аминокислотами, HOSA существует в твердом состоянии в виде цвиттерион: H3N+OSO3−. Напоминает молекулу аммиака. координировать ковалентно связанный к сульфатной группе.[8]
Реакции
HOSA при основных условиях реагирует как нуклеофил и в нейтральных и кислых условиях как электрофил.[3][9]
Аминации
Он реагирует с третичными аминами с образованием тризамещенных солей гидразиния и с пиридином с образованием 1-аминопиридиниевой соли.[10]
Из солей 1-аминопиридиния фотохимически активный 1-N-иминопиридиниевые илиды доступны ацилирование.[11] В фотохимическая перегруппировка полученных 1-N-иминипиридин-илидов приводит с высокими выходами до 1ЧАС-1,2-диазепины[12]
N-минирование 1ЧАС-бензотриазол с гидроксиламином-О-сульфоновая кислота дает смесь 1-аминобензотриазола (основной продукт) и 2-аминобензотриазола (второстепенный продукт). Из 1-аминотриазола, бензин образуется с почти количественным выходом при окислении свинец (IV) ацетат, который быстро димеризуется к бифенилен с хорошими урожаями.[13]
Электронный дефицит гетероциклы, Такие как тетразол, может быть N-аминированный с гидроксиламином-О-сульфоновая кислота, а еще более электронодефицитные соединения, такие как 5-нитротетразол, реагируют только с более сильными аминирующими агентами, такими как О-тозилгидроксиламин или О- мезитилен сульфонилгидроксиламин до аминосоединений, которые исследовались как взрывчатые вещества.[14]
в N-аминирования незамещенного тетразола получают смесь 1-амино- и 2-аминотетразола.
Также соединения серы (такие как тиоэфиры) может быть аминирован гидроксиламином-О-сульфоновая кислота в сульфинимины (изостерический с сульфоксидами, но гораздо более нестабильный) или соединения фосфора (такие как трифенилфосфин) может быть аминирован фосфинимиды через промежуточный гидросульфат аминотрифенилфосфония.[15]
Реакция гидроксиламина-О-сульфоновая кислота с металлическими солями сульфиновых кислот в растворе ацетата натрия дает первичные сульфонамиды с очень хорошими выходами.[16]
Diimine может сформироваться на месте из гидроксиламинаО-сульфоновая кислота или гидроксиламин-О-смеси гидроксиламинсульфата сульфоновой кислоты, которые гидрируют селективно сопряженные кратные связи [20].
С карбонильными соединениями
При комнатной температуре и ниже гидроксиламин-О-сульфоновая кислота реагирует с кетонами и альдегидами как нуклеофил с соответствующим оксимомО-сульфоновые кислоты или их соли.[17] Оксим-О-сульфоновые кислоты альдегидов реагируют выше комнатной температуры при отщеплении серной кислоты с высокими выходами до нитрилы.[18]
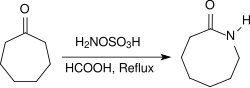
Алифатические кетоны в аналогичных условиях образуют оксимы с очень высоким выходом, арилалкилкетоны реагируют в Перестановка Бекмана к амидам. При нагревании с обратным холодильником в течение нескольких часов в кислых условиях (например, в присутствии концентрированного Муравьиная кислота) алициклические кетоны реагируют с образованием лактамы с высокими урожаями.[19]
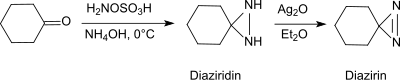
В основных условиях в присутствии первичных аминов гидроксиламин-О-формы сульфоновой кислоты с альдегидами и кетонами (например, циклогексанон[20]) диазиридины, которые легко окисляются до более стабильных диазиринов.
В результате реакции также получают замещенные азиридины из простых альдегидов и кетонов с высоким выходом и диастереоселективностью.[21]
1,2-бензизоксазол эффективно продуцируется нуклеофильной атакой гидроксиламин-О-сульфоновой кислоты к карбонильной группе 2-гидроксибензальдегида с последующей циклизацией.[22]
1,2-бензизоксазол является структурным элементом антипсихотического средства. рисперидон и палиперидон, так же хорошо как противосудорожное средство зонисамид.
В одноразовая реакция, N-арил [3,4-d] пиразолопиримидины получают с хорошими выходами из простого 4,6-дихлорпиримидин-5-карбоксальдегида,[23]
который можно использовать как пурин аналоги для широкого спектра диагностических и терапевтических применений.[24]
Дальнейшие реакции
В хемилюминесценция системы люминол/хлорид кобальта (II) резко усиливается добавлением гидроксиламин-О-сульфоновая кислота.[25]
Рекомендации
- ^ а б Matsuguma, Harold J .; Одриет, Людвиг Ф .; Вермейстер, Герберт Л. (1957). Гидроксиламин-О-Сульфоновая кислота. Неорг. Synth. Неорганические синтезы. 5. С. 122–125. Дои:10.1002 / 9780470132364.ch32. ISBN 9780470132364.
- ^ а б c Виберг, Эгон; Виберг, Нильс (2001). «Сернистые соединения азота». Неорганическая химия. Академическая пресса. С. 675–677. ISBN 978-0-12-352651-9.
- ^ а б Уоллес, Раймонд Г. (1980). «Гидроксиламин-О-сульфоновая кислота - универсальный синтетический реагент ». Aldrichimica Acta. 13 (1): 3–11.
- ^ Радемахер, П. (2014). "Класс продукта 7: гидразины и соли гидразиния (40.7.1.1.9.2 - Использование гидроксиламина-О-сульфоновые кислоты ». В Эндерсе, Дитер; Шауман, Э. (ред.). Соединения с одной насыщенной связью углерод – гетероатом: амин. N-Оксиды, галоамины, гидроксиламины и аналоги серы и гидразины. Наука синтеза: методы Губена-Вейля молекулярных превращений. 40b. Георг Тиме Верлаг. п. 1171. ISBN 978-3-13-172181-5.
- ^ Патент США 3281209, Wehrmeister, Герберт Л. и Гарольд И. Яловиц, "Процесс получения гидроксиламин-О-сульфоновая кислота », опубликовано 1966-10-25, выпущено 1966-10-25, присвоено Корпорация коммерческих растворителей
- ^ Sommer, F .; Schulz, O.F .; Нассау, М. (1925). "Uber die Sulfoperamidsäure" [О сульфопераминовой кислоте]. Z. Anorg. Allg. Chem. (на немецком). 147 (1): 142–155. Дои:10.1002 / zaac.19251470115.
- ^ Ратке, Майкл В .; Миллард, Алан А. (1978). «Бораны в функционализации олефинов до аминов: 3-пинанамин (бицикло [3.1.1] гептан-3-амин, 2,6,6-триметил-)». Органический синтез. 58: 32. Дои:10.15227 / orgsyn.058.0032.; Коллективный объем, 6, п. 943
- ^ Baenziger, Norman C .; Ремень, Роджер Ф .; Гебель, Кэрол В. (1967). «Кристаллическая структура гидроксиламина-О-сульфоновая кислота ». Неорг. Chem. 6 (3): 511–514. Дои:10.1021 / ic50049a017.
- ^ Эрдик, Эндер (2001). «Гидроксиламин-О-сульфоновая кислота». Гидроксиламин-О-Сульфоновая кислота. Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rh058. ISBN 978-0-471-93623-7.
- ^ Р. Гёсль; А. Меувзен (1963). «1-Аминопиридиния йодид». Орг. Synth. (на немецком). 43: 1. Дои:10.15227 / orgsyn.043.0001.
- ^ Дж. Стрейт (1991). "Фотохимия N-Иминопиридиниум-илиды в ретроспективе. От простой концепции к некоторым приложениям ». ЧИМИЯ (на немецком). 45 (3): 65–76.
- ^ Дж. Стрейт (1977). «Фотохимия ароматических-N-илиды. Модели перестановки и фрагментации ". Pure Appl. Chem. (на немецком). 49 (3): 305–315. Дои:10.1351 / pac197749030305.
- ^ Campbell, C.D .; Рис, К.В. (1969). «Реакционные промежуточные соединения. Часть I. Синтез и окисление 1- и 2-аминобензотриазола». J. Chem. Soc. C. 1969 (5): 742–747. Дои:10.1039 / J39690000742.
- ^ Т.М. Клапётке; D.G. Пирси; Дж. Стирсторфер (2012). «Аминирование энергичных анионов: высокоэффективные энергетические материалы». Dalton Trans. (на немецком). 41 (31): 9451–9459. Дои:10.1039 / C2DT30684K. PMID 22751656.
- ^ Р. Аппель; В. Бюхнер; Э. Гут (1958). "Zur Kenntnis des Imins, I. Über Phosphinimine und Sulfinimine". Justus Liebigs Ann. Chem. (на немецком). 618 (1): 53–58. Дои:10.1002 / jlac.19586180107.
- ^ S.L. Грэм; T.H. Шольц (1986). «Реакция солей сульфиновой кислоты с гидроксиламином-О-сульфоновая кислота. Полезный синтез первичных сульфаниламидов ». Синтез (на немецком). 1986 (2): 1031–1032. Дои:10.1055 / с-1986-31862.
- ^ Дж. Стрейт; К. Физе (1977). «Нуклеофильные и электрофильные свойства атома азота в Опроизводные сульфонилгидроксиламина ». Tetrahedron Lett. (на немецком). 18 (37): 3297–3300. Дои:10.1016 / S0040-4039 (01) 83223-8.
- ^ К. Физе; Дж. Стрейт (1974). «Гидроксиламин-О-сульфоновая кислота: удобный реагент для окислительного превращения альдегидов в нитрилы ». Tetrahedron Lett. (на немецком). 15 (36): 3187–3188. Дои:10.1016 / S0040-4039 (01) 91857-X.
- ^ Г.А. Олах; А.П. Фунг (1985). «Гексагидро-2- (1ЧАС) -азоцинон ». Орг. Synth. (на немецком). 63: 188. Дои:10.15227 / orgsyn.063.0188.
- ^ Э. Шмитц; Р. Ом (1965). «3,3-Пентаметилендиазиридин». Орг. Synth. (на немецком). 45: 83. Дои:10.15227 / orgsyn.045.0083.
- ^ A.W. Биби; Э. Ф. Домайер; Г. Моура-Леттс (2015). «Диастереоселективный синтез замещенных диазиридинов из простых кетонов и альдегидов». Chem. Commun. (на немецком). 51 (70): 13511–13514. Дои:10.1039 / C5CC04813C. PMID 26216745.
- ^ Д.С. Кемп; Р. Б. Вудворд (1965). "The NКатион -этилбензизоксазолий — I: Получение и реакции с нуклеофильными частицами ". Тетраэдр (на немецком). 21 (11): 3019–3035. Дои:10.1016 / S0040-4020 (01) 96921-2.
- ^ L.E. Эванс; Доктор медицины Чизмен; К. Джонс (2012). "Циклизация с образованием связи N – N для однореакторного синтеза N-Арил [3,4-d] пиразолопиримидины ». Орг. Lett. (на немецком). 14 (13): 3546–3549. Дои:10.1021 / ol301561a. ЧВК 3390909.
- ^ К. Моррилл; С. Бабу; Н.Г. Усадьба; Ю.-К. Луна (2013). «Синтез 1,4-дизамещенных пиразоло [3,4-d] пиримидинов из 4,6-дихлорпиримидин-5-карбоксальдегида: понимание селективности и реакционной способности». Синтез (на немецком). 45 (13): 1791–1806. Дои:10.1055 / с-0033-1338862.
- ^ М. Сакиб; В. Гао; Дж. Лай; Л. Ци; С. Маджид; M.R.H.S. Гилани; Г. Сюй (2015). «Гидроксиламин-О-сульфоновая кислота как эффективное сореагентант хемилюминесценции люминола для селективного и чувствительного обнаружения ». Chem. Commun. (на немецком). 51 (30): 6536–6539. Дои:10.1039 / C5CC01090J. PMID 25766485.