WikiDer > Мутация BRCA - Википедия
| BRCA мутация | |
|---|---|
 | |
| Гены BRCA - это гены-супрессоры опухолей, изображенные здесь на их соответствующих хромосомах. BRCA 1 имеет цитогенетическое расположение 17q21 или q-плечо хромосомы 17 в положении 21. BRCA 2 имеет цитогенетическое расположение 13q12.3 или q-плечо хромосомы 13 в положении 12.3. Оба гена производят белки, которые помогают восстанавливать поврежденную ДНК, сохраняя стабильный генетический материал клетки. Поврежденный ген BRCA в любом месте может привести к повышенному риску рака, особенно груди или яичников у женщин. | |
| Специальность | Медицинская генетика |
А BRCA мутация это мутация в любом из BRCA1 и BRCA2 гены, которые являются генами-супрессорами опухолей. Были идентифицированы сотни различных типов мутаций в этих генах, некоторые из которых были признаны вредными, в то время как другие не доказали свою эффективность. Вредные мутации в этих генах могут вызывать синдром наследственного рака груди и яичников у пострадавших. Только 5-10% рак молочной железы случаи у женщин относятся к BRCA1 и BRCA2 мутации (с BRCA1 мутации встречаются немного чаще, чем BRCA2 мутации), но влияние на женщин с мутацией гена более глубокое.[1] Женщины с вредными мутациями в BRCA1 или же BRCA2 имеют риск рака груди, который примерно в пять раз превышает нормальный риск, и риск рака яичников, который примерно в десять-тридцать раз выше нормы.[2] Риск рака груди и яичников выше у женщин с высоким риском. BRCA1 мутации, чем с BRCA2 мутация. Наличие мутации высокого риска не гарантирует, что у женщины разовьется какой-либо тип рака, и не подразумевает, что любой появившийся рак на самом деле вызван мутацией, а не каким-либо другим фактором.
Мутации высокого риска, которые нарушают важный безошибочный процесс восстановления ДНК (гомологически направленный ремонт), значительно увеличивают риск развития у человека рак молочной железы, рак яичников и некоторые другие виды рака. Почему BRCA1 и BRCA2 мутации приводят преимущественно к раку груди и яичников, что неизвестно, но отсутствие BRCA1 функция, кажется, приводит к нефункциональной Инактивация Х-хромосомы. Не все мутации связаны с высоким риском; некоторые кажутся безобидными вариациями. Риск рака, связанный с любой данной мутацией, значительно варьируется и зависит от точного типа и местоположения мутации и, возможно, других индивидуальных факторов.
Мутации могут быть унаследованы от любого из родителей и могут передаваться как сыновьям, так и дочерям. Каждый ребенок генетический носительнезависимо от пола имеет 50% шанс унаследовать мутировавший ген от родителя, несущего мутацию. В результате половина людей с BRCA генные мутации - мужские, которые затем передают мутацию 50% своего потомства, мужского или женского пола. Риск BRCAчисло случаев рака груди у мужчин с мутацией выше, чем у других мужчин, но все же низкое.[3] Тем не мение, BRCA мутации могут увеличить риск других видов рака, таких как рак толстой кишки, панкреатический рак, и рак простаты.
Методы диагностики вероятности наличия у пациента мутаций в BRCA1 и BRCA2 заболели раком были покрыты патенты принадлежит или контролируется Мириады генетики.[4][5] Бизнес-модель Myriad, предусматривающая эксклюзивное предложение диагностических тестов, привела к тому, что Myriad из стартапа в 1994 году превратилась в публичную компанию с 1200 сотрудниками и годовой выручкой около 500 миллионов долларов в 2012 году;[6] это также привело к спорам по поводу высоких цен и невозможности получить второе мнение из других диагностических лабораторий, что, в свою очередь, привело к появлению вехи Ассоциация молекулярной патологии против Myriad Genetics иск.[7]
Влияние на здоровье
Женщины с вредными мутациями в BRCA1 или же BRCA2 гены имеют высокий риск развития грудь и / или рак яичников. Поскольку в разных исследованиях рассматриваются разные группы населения, и поскольку разные типы мутаций имеют несколько разные риски, риск лучше всего выражать в виде диапазона, а не одного числа.[8]:89–111
Примерно от 50% до 65% женщин, рожденных с вредоносной мутацией в BRCA1 к 70 годам разовьется рак груди, а к 70 годам у 35–46% разовьется рак яичников. Приблизительно от 40 до 57% женщин с вредоносной мутацией в BRCA2 к 70 годам разовьется рак груди, а к 70 годам у 13–23% разовьется рак яичников.[8]:89–111[9]
Женщины с раком груди, связанным с BRCA мутации имеют до 40% вероятности развития нового первичного рака груди в течение 10 лет после первоначального диагноза, если они не получили тамоксифен лечение или иметь овариэктомия.[3] В этих условиях десятилетний риск рака яичников у женщины также увеличивается на 6-12%.[3]
Статистика для BRCA-зависимый рак яичников, как правило, включает не только рак яичники сами, но также рак брюшины и очень редкий, но несколько легче обнаруживаемый рак Фаллопиевы трубы. Женщины с BRCA частота мутаций более чем в 100 раз превышает нормальный уровень рака маточных труб.[8]:275–302 Эти три типа рака бывает трудно различить на поздних стадиях.
Начало рака
BRCAСвязанный с этим рак груди появляется в более раннем возрасте, чем спорадический рак груди.[8]:89–111 Утверждалось, что BRCAСвязанный с этим рак молочной железы более агрессивен, чем нормальный рак молочной железы, однако большинство исследований в конкретных популяциях показывают незначительную разницу в выживаемости или ее отсутствие, несмотря на кажущиеся худшие прогностические факторы.[10][11][12]
- BRCA1 связан с тройной отрицательный рак груди, который не реагирует на гормональное лечение и не может быть эффективно вылечен некоторыми лекарствами, такими как трастузумаб. Рак груди часто появляется примерно на два десятилетия раньше, чем обычно.[8]:89–111
- BRCA2 связан в первую очередь с раком груди в постменопаузе, хотя риск рака груди в пременопаузе значительный. Обычно он очень чувствителен к гормональному лечению.[8]:89–111
BRCAСвязанный с этим рак яичников и фаллопиевых труб поддается лечению лучше, чем в среднем, потому что он необычно чувствителен к химиотерапии на основе платины, такой как цисплатин.[8]:275–302 BRCA1-зависимый рак яичников появляется в более молодом возрасте, но риск для женщин с BRCA2 заметно поднимается во время или вскоре после менопаузы.[8]:275–302
Влияние на выживание
72 / 100 | |
46 / 100 | |
11 / 100 72% женщин с BRCA1 мутации и 46% женщин с BRCA2 мутация (и отсутствие скрининга или медицинского вмешательства), кто умрет до 70 лет, умрет от рака груди или яичников. 11% женщин в США, которые умирают до 70 лет, умрут от рака груди или яичников.[13] |
| Группа | Процент доживших до 70 лет |
|---|---|
| BRCA1 мутация | 59 |
| BRCA2 мутация | 71 |
| Типичная женщина | 84 |
25-летняя женщина без мутации BRCA с вероятностью 84% доживут до 70 лет.[13] Из тех, кто не выжил, 11% умирают либо от рака груди, либо от рака яичников, а 89% - от других причин.
По сравнению с этим женщина с высоким риском BRCA1 мутация, если бы она имела скрининг на рак груди но никакое профилактическое медицинское или хирургическое вмешательство не имело бы только 59% шансов достичь возраста 70 лет, что на двадцать пять процентных пунктов ниже, чем обычно. Из тех женщин, которые не выживают, 26% умрут от рака груди, 46% от рака яичников и 28% от других причин.[13]
Женщины с высоким риском BRCA2 мутации при скрининге, но без профилактического медицинского или хирургического вмешательства имели бы только 71% шанс достичь возраста 70 лет, что на тринадцать процентных пунктов ниже нормы. Из тех, кто не выжил, 21% умрут от рака груди, 25% от рака яичников и 54% от других причин.[13]
Вероятность дожить до возраста как минимум 70 лет можно повысить с помощью нескольких медицинских вмешательств, в частности профилактической мастэктомии и овариэктомии.[13]
Рак груди у мужчин
Мужчины с BRCA мутации резко увеличились относительный риск развития рака груди, но поскольку общая заболеваемость раком груди у мужчин настолько низка, абсолютный риск равен или ниже, чем риск для женщин без BRCA мутация.[8]:Ch8 Примерно от 1% до 2% мужчин с BRCA1 мутация разовьет рак груди к 70 годам. Приблизительно 6% мужчин с BRCA2 мутация разовьет рак груди к 70 годам, что примерно равно риску для женщин без BRCA мутация. Очень немногие мужчины с предрасполагающей мутацией или без нее заболевают раком груди до 50 лет.[8]:Ch8
Примерно половина мужчин, у которых развивается рак груди, имеют мутацию в BRCA ген или в одном из других генов, связанных с наследственные синдромы рака груди и яичников.
Рак груди у мужчин лечится так же успешно, как рак груди у женщин, но мужчины часто игнорируют признаки и симптомы рака, такие как болезненная область или необычный отек, который может быть не больше крупицы рис, пока не достигнет поздней стадии.[8]:Ch8
В отличие от других мужчин, мужчины с BRCA мутации, особенно BRCA2 мутации, может принести пользу профессиональная и самостоятельная обследование груди. Медицинская визуализация обычно не рекомендуется, но потому что мужчины BRCA2 носители имеют риск рака груди, который очень похож на общее женское население, стандартный ежегодный маммограмма Программа может быть адаптирована для этих мужчин из группы высокого риска.[8]:Ch8
Другие виды рака
Мутации связаны с повышенным риском развития любого вида инвазивного рака, включая рак желудка, панкреатический рак, рак простаты и рак толстой кишки.[14] У носителей нормальный риск развития рака (и других заболеваний), связанный с пожилым возрастом, курением, употреблением алкоголя, плохим питанием, недостатком физических упражнений и другими известными факторами риска, плюс дополнительный риск, связанный с генетическими мутациями и повышенной восприимчивостью к повреждениям. от ионизирующего излучения, в том числе природного фоновое излучение.[8]:39–50
Мужчины с BRCA мутации не могут вызвать рак яичников, но вероятность их развития в два раза выше, чем у не-носителей рак простаты в более молодом возрасте.[8]:Ch8 Риск меньше и оспаривается для BRCA1 перевозчики; до одной трети BRCA2 Ожидается, что носители мутации разовьют рак простаты до 65 лет. BRCA Носители мутации, как правило, появляются на десять лет раньше, чем обычно, и имеют тенденцию быть более агрессивными, чем обычно. В результате ежегодный скрининг простаты, включая пальцевое ректальное исследованиесреди известных носителей уместно в возрасте 40 лет, а не в возрасте 50 лет.[8]:Ch8
Рак поджелудочная железа имеет тенденцию сбегать семьями, даже среди BRCA семьи.[8]:Ch8 А BRCA1 мутация примерно вдвое или втрое увеличивает риск развития рака поджелудочной железы в течение жизни; а BRCA2 мутация увеличивается в пять раз. От 4% до 7% людей с раком поджелудочной железы имеют BRCA мутация.[14] Однако, поскольку рак поджелудочной железы встречается относительно редко, люди с BRCA2 мутации, вероятно, сталкиваются с абсолютным риском около 5%. Как и рак яичников, он обычно не вызывает симптомов на ранних, излечимых стадиях. Как и рак простаты, рак поджелудочной железы, связанный с BRCA мутации, как правило, появляются примерно на десять лет раньше, чем ненаследственные случаи.[14] Бессимптомное обследование инвазивный и может быть рекомендован только BRCA2 носители, у которых также есть семейный анамнез рака поджелудочной железы.[8]:Ch8
Меланома это самый смертоносный рак кожи, хотя на ранних стадиях он легко поддается лечению. Нормальная вероятность развития меланомы зависит от расы, количества родинки наличие у человека, семейный анамнез, возраст, пол и степень воздействия УФ-излучения. BRCA2 носители мутаций имеют примерно в два или три раза больший риск, чем обычно, включая риск выше среднего. меланома глаза.[8]:Ch8[14]
Рак двоеточие примерно так же часто встречается как у мужчин, так и у женщин в развитом мире, как и рак груди среди женщин среднего риска, причем он диагностируется примерно у 6% людей, как правило, старше 50 лет.[8]:Ch8 Как и спорадический рак простаты, это многофакторное заболевание, на которое влияют возраст, диета и подобные факторы. BRCA носители мутаций имеют риск выше среднего риска этого распространенного рака, но риск не так высок, как у некоторых других наследственные раки. В некоторых случаях риск может быть в четыре раза выше нормы. BRCA1 семей, и удвоить нормальный риск среди BRCA2 перевозчики. Как и рак поджелудочной железы, возможно, только некоторые BRCA мутации или некоторые BRCA семьи несут дополнительный риск; в отличие от других BRCA- вызванный раком, он не появляется в более раннем возрасте, чем обычно.[8]:Ch8 Обычный скрининг рака толстой кишки обычно рекомендуется BRCA носители мутации.
Мутации в BRCA1 и BRCA2 сильно замешаны в некоторых гематологические злокачественные новообразования. BRCA1 мутации связаны острый миелолейкоз и хронический миелолейкоз.[15] Мутации BRCA2 также встречаются во многих Т-клеточные лимфомы и хронические лимфолейкозы.[15]
Деторождение
Дилемма о том, иметь ли детей или нет, может стать источником стресса для женщин, которые узнают о своем BRCA мутации в детородном возрасте.[16]
Вероятно, эффект от BRCA генная мутация в целом плодородие,[17] хотя женщины с BRCA мутация с большей вероятностью будет иметь первичная недостаточность яичников.[18][19] BRCA носители мутации могут с большей вероятностью родить девочек, чем мальчиков,[20] однако это наблюдение было приписано предвзятость установления.[21][22]
Если оба родителя являются носителями BRCA мутация, тогда предимплантационная генетическая диагностика иногда используется для предотвращения рождения ребенка с BRCA мутации.[8]:82–85 Наследование двух BRCA1 о мутациях (по одной от каждого родителя) никогда не сообщалось, и считается, что это смертельный врожденный дефект. Наследование одного BRCA1 мутация и один BRCA2 время от времени сообщалось о мутации; риск развития у ребенка любого данного типа рака - это более высокий риск двух генов (например, риск рака яичников от BRCA1 и риск рака поджелудочной железы от BRCA2). Наследование двух BRCA2 мутации производят Анемия Фанкони.[8]:82–85
Каждая беременность у генетически типичных женщин связана со значительным снижением риска развития рака груди у матери после 40 лет.[16] Чем моложе женщина на момент первых родов, тем большую защиту от рака груди она получает.[8]:113–142 Кормление грудью более года защищает от рака груди.[8]:113–142 Беременность также защищает от рака яичников у генетически типичных женщин.[16]
Хотя некоторые исследования дали разные результаты, женщины с BRCA обычно не ожидается, что мутации получат эти значительные защитные преимущества.[8]:113–142[16] Текущие исследования слишком ограничены и неточны, чтобы можно было рассчитать конкретные риски.[16] Однако были выявлены следующие общие тенденции:
- Для женщин с BRCA1 мутации, возраст женщины, когда она впервые рожает, не связан с ее риском рака груди.[16] Вынашивание ребенка не обеспечивает защиты от рака груди, если только у женщины не будет пяти или более доношенных беременностей, после чего она получает лишь скромную защиту.[16] Как и у генетически типичных женщин, беременность защищает от рака яичников у BRCA1 женщины.[16] Кормление грудью более года значительно защищает от рака груди.[16] Этот эффект может достигать 19% за год кормления грудью, что намного выше, чем у генетически типичных женщин.[23] Влияние длительного грудного вскармливания на рак яичников, если таковое имеется, неясно.[16]
- Для женщин с BRCA2 мутации, каждая беременность парадоксальным образом связана со статистически значимым увеличением риска рака груди.[16] В отличие от генетически типичных женщин или женщин с BRCA1 мутации, грудное вскармливание не влияет ни на один из видов рака у женщин с BRCA2 мутации.[16] Ограниченные и противоречивые данные предполагают, что, в отличие от других женщин, беременность не снижает значительно риск рака яичников у женщин с BRCA2 мутация и может увеличить ее.[16]
Генетика
Обе BRCA гены гены-супрессоры опухолей которые производят белки, которые используются клеткой в ферментативный путь который производит очень точный, идеально подобранный ремонт молекул ДНК, имеющих двухцепочечные разрывы.[8]:39–50[24] Для этого пути требуются белки, продуцируемые несколькими другими генами, включая CHK2, FANCD2 и Банкомат.[14] Вредные мутации в любом из этих генов выводят из строя ген или белок, который он производит.
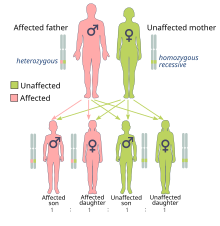
Риск рака, вызванный BRCA1 и BRCA2 мутации наследуются в доминирующий мода, хотя обычно мутировал только один аллель наследуется напрямую.[25] Это связано с тем, что люди с мутацией, вероятно, приобретут вторую мутацию, что приведет к доминантному проявлению рака. Мутировавший BRCA ген может быть унаследован от любого из родителей. Поскольку они унаследованы от родителей, они классифицируются как наследственный или же мутации зародышевой линии скорее, чем приобретенный или же соматические мутации. Рак, вызванный мутировавшим геном, унаследованным от родителей человека, является наследственный рак а не спорадический рак.
Потому что у людей есть диплоид В геноме каждая клетка имеет две копии гена (по одной от каждого биологического родителя). Обычно только одна копия содержит унаследованную мутацию, приводящую к отключению, поэтому пораженный человек гетерозиготный для мутации. Однако, если функциональная копия повреждена, клетка вынуждена использовать альтернативные механизмы восстановления ДНК, которые более подвержены ошибкам. Утрата функциональной копии называется потеря гетерозиготности (LOH).[26] Любые возникающие ошибки в репарации ДНК могут привести к гибели клетки или раковой трансформации клетки.[8]:39–50
Есть много вариантов BRCA гены, и не все изменения связаны с одинаковым риском.[8]:39–50Некоторые варианты безвредны; другие известны как очень вредные. Немного однонуклеотидный полиморфизм может представлять лишь небольшой риск или может представлять риск только при наличии других мутаций или при определенных обстоятельствах. В остальных случаях вреден ли вариант - неизвестно. Варианты классифицируются следующим образом:[8]:39–50:109
- Вредная мутация: Доказано, что изменение вызывает значительные риски. Часто это мутации сдвига рамки считывания которые не позволяют клетке производить больше первой части необходимого белка.
- Предполагается вредный: Хотя ничего не доказано, в настоящее время считается, что это изменение вредно.
- Вариант неопределенной значимости (VUS): неясно, повлияет ли это изменение. Это обычный результат теста, и большинство вариаций началось именно с этой категории. По мере получения дополнительных доказательств они переклассифицируются.
- Вариант в пользу полиморфизма: Пока ничего не доказано, вариация в настоящее время считается безвредной.
- Доброкачественный полиморфизм: Изменение классифицировано как безвредное. О них можно сообщить как об отсутствии мутации.
Вредные мутации имеют высокие, но не полные генетические пенетрантность, что означает, что люди с мутацией имеют высокий риск развития в результате заболевания, но что у некоторых людей не разовьется рак, несмотря на наличие вредной мутации.
Диагностика
Генетическое консультирование рекомендуется женщинам, чей личный или семейный анамнез указывает на вероятность мутации выше средней.[27] Целью генетического консультирования является информирование человека о вероятности положительного результата, рисках и преимуществах тестирования, ограничениях тестов, практическом значении результатов и действиях по снижению риска, которые можно предпринять, если результаты положительные. Их также учат поддерживать людей в любых эмоциональных реакциях и быть нейтральным человеком, который помогает клиенту принимать собственное решение в информированное согласие модели, не заставляя клиента делать то, что может сделать консультант. Поскольку знание мутации может вызвать серьезное беспокойство, некоторые люди предпочитают не проходить тестирование или откладывать тестирование на более поздний срок.[8]:51–74
Относительный показания для тестирования мутации в BRCA1 или BRCA2 для вновь диагностированных или членов семьи включают история семьи среди родственников 1-й (FDR), 2-й (SDR) или 3-й (TDR) степени родства, как правило, на одной стороне семьи, но не ограничиваясь:[28]
- Известная мутация (BRCA1 или BRCA2) в гене предрасположенности к раку в семье
- Женщины, пострадавшие от любых Рак молочной железы поставлен диагноз до 30 лет[29]
- Женщины с тройным отрицательным раком груди (TNBC) (рецептор эстрогена отрицательный, рецептор прогестерона отрицательный, и HER2 / neu отрицательный) в возрасте до 50 лет
- Двое родственников (FDR / SDR) с диагнозом моложе 45 лет
- Три родственника (FDR / SDR) с диагнозом средний возраст 50 лет или меньше
- Четверо родственников в любом возрасте
- Рак яичников с диагнозом рака молочной железы у другого родственника или родственника, у которого диагностирован рак груди.
- Одинокий член семьи с раком груди и яичников
- Рак груди у мужчин
- Рак поджелудочной железы с раком груди или яичников у одного и того же человека или из одной части семьи
- Евреи ашкенази или польское происхождение с одним членом семьи FDR, пораженным раком груди или яичников в любом возрасте[30]
Считается, что тестирование маленьких детей с медицинской точки зрения неэтичный потому что результаты теста не повлияют на то, как заботятся о здоровье ребенка.[8]:82–85
Тестовая процедура
Доступны два типа тестов.[8]:51–74 Оба обычно используют образец крови, хотя можно провести анализ слюны. Самый быстрый, простой и недорогой тест использует положительные результаты теста кровный родственник и проверяет только одну мутацию, которая, как известно, присутствует в семье. Если ни один из родственников ранее не раскрыл положительных результатов теста, то полный тест, который проверяет всю последовательность обоих BRCA1 и BRCA2 может быть выполнено. В некоторых случаях из-за эффект основателя, Еврейская этническая принадлежность может быть использована для сужения тестирования и быстрой проверки трех наиболее распространенные мутации, наблюдаемые среди евреев ашкенази.[8]:51–74
Тестирование обычно покрывается медицинская страховка и государственные программы здравоохранения для людей с высоким риском мутации и не покрываемые страховкой для людей с низким риском.[8]:51–74 Цель ограничить тестирование людьми из группы высокого риска - повысить вероятность того, что человек получит значимый, действенный результат теста, а не выявить вариант неизвестной значимости (VUS). В Канаде люди, которые демонстрируют свой статус высокого риска, соблюдая определенные правила, сначала направляются в специализированную программу лечения наследственного рака, и, если они решают пройти тестирование, стоимость теста полностью покрывается. В США в 2010 году тестирование в одном месте стоило от 400 до 500 долларов, а полный анализ стоил около 3000 долларов за ген, и эти расходы обычно покрывались частным медицинским страхованием для людей, которые считались подверженными высокому риску.
Тест назначает врач, обычно онколог, и результаты всегда возвращаются врачу, а не непосредственно пациенту. Скорость получения результатов зависит от теста (анализ на одном участке требует меньше лабораторного времени) и от имеющейся инфраструктуры. В США результаты тестов обычно возвращаются в течение одной или нескольких недель; в Канаде пациенты обычно ждут результатов тестов от восьми до десяти месяцев.[8]:51–74
Интерпретация теста
Положительный результат теста на известную вредоносную мутацию является доказательством предрасположенности, хотя не гарантирует, что у человека разовьется какой-либо тип рака. Отрицательный результат теста, если известно, что в семье присутствует конкретная мутация, показывает, что у человека нет BRCAсвязанная с предрасположенностью к раку, хотя это не гарантирует, что у человека не разовьется ненаследственный случай рака. Сам по себе отрицательный результат теста не означает, что у пациентки нет наследственной предрасположенности к раку груди или яичников. В семье может быть другая генетическая предрасположенность к раку, связанная с каким-либо другим геном.[8]:89–111
Профилактика рака
Доступны различные варианты скрининга и вмешательства для управления BRCAсвязанные с раком риски. Обследования корректируются с учетом индивидуальных и семейных факторов риска.
Поскольку эти методы скрининга не предотвращают рак, а просто пытаются выявить его на ранней стадии, иногда практикуются многочисленные методы профилактики с разными результатами.[8]:175–207
Скрининг
Интенсивный скрининг рака режим обычно рекомендуется женщинам с вредным или подозреваемым BRCA мутации, чтобы как можно раньше обнаружить новые виды рака. Типичная рекомендация включает частые скрининг на рак груди а также тесты на выявление рака яичников.[8]:175–207
Визуализирующие исследования груди обычно включают МРТ груди (магнитно-резонансная томография) один раз в год в возрасте от 20 до 30 лет, в зависимости от возраста, в котором у родственников был диагностирован рак груди. Маммограммы обычно используются только в преклонном возрасте, поскольку есть основания полагать, что BRCA носители более восприимчивы к индуцированию рака груди из-за повреждения рентгеновскими лучами, чем население в целом.[31]
Альтернативы включают грудь ультразвуковая эхография, Компьютерная томография, ПЭТ сканирование, сцинтимаммография, эластография, термография, протоковый лаваж, и протоколы экспериментального скрининга, некоторые из которых надеются выявить биомаркеры при раке груди (молекулы, которые появляются в крови, когда начинается рак груди).[8]:175–207
Скрининг на рак яичников обычно включает: ультразвуковая эхография тазовой области, обычно два раза в год.[8]:175–207 Женщины также могут использовать анализ крови за CA-125 и клинические тазовые экзамены. Анализ крови относительно плохой чувствительность и специфичность при раке яичников.[8]:175–207[32]
При скрининге как груди, так и яичников области ткани, которые выглядят подозрительно, исследуются либо с помощью дополнительных изображений, возможно, с использованием другого типа изображений, либо с задержкой, либо с биопсия подозрительных участков.
Медикамент
Противозачаточные таблетки связаны со значительно более низким риском рака яичников у женщин с BRCA мутации.[33][34] 2013 год метаанализ обнаружили, что использование оральных контрацептивов было связано с уменьшением на 42% относительный риск при раке яичников ассоциация была сходной для мутаций BRCA1 и BRCA2. Использование оральных контрацептивов не было значительно связано с риском рака груди, хотя небольшое увеличение риска не достигло Статистическая значимость наблюдалось.[33][34] Метаанализ 2011 года показал, что использование ОК было связано с относительным снижением риска рака яичников на 43% у женщин с BRCA мутации, а данные о риске рака груди в BRCA Носители мутации при использовании оральных контрацептивов были неоднородными, и результаты были противоречивыми.[35]
Селективные модуляторы рецепторов эстрогена, конкретно тамоксифен, было обнаружено, что они снижают риск рака груди у женщин с BRCA мутации, у которых не удалена грудь.[8]:113–142 Эффективен как для первичная профилактика (предотвращение первого случая рака груди) у женщин с BRCA2 мутации, но не BRCA1 мутации, и для вторичная профилактика (предотвращение второго, независимого рака груди) в обеих группах женщин. Было обнаружено, что прием тамоксифена в течение пяти лет вдвое снижает риск рака груди у женщин, которые имеют высокий риск рака груди по любой причине, но могут иметь серьезные побочные эффекты, такие как катаракта, сгустки крови и рак эндометриянаряду с проблемами качества жизни, такими как приливы, некоторые женщины прекращают его использование, а некоторые врачи ограничивают его использование женщинами с атипичными опухолями груди. Тамоксифен противопоказан для женщин, которым наиболее вероятны общие осложнения. Ралоксифен (Evista), который имеет сниженный риск побочных эффектов, используется в качестве альтернативы, но не изучался в BRCA носители мутации в частности. Использование тамоксифена можно сочетать с овариэктомией для еще большего снижения риска рака груди, особенно у женщин с BRCA2 мутации.[8]:113–142
Ингибиторы ароматазы лекарства, которые предотвращают выработку эстрогена в надпочечники и жировая ткань. У них меньше побочных эффектов, чем у селективных модуляторов рецепторов эстрогена, таких как тамоксифен, но они не работают у женщин в пременопаузе, поскольку не препятствуют выработке эстрогена яичниками.[8]:113–142
Хирургия
Известно, что несколько типов профилактических операций существенно снижают риск рака у женщин с высоким риском. BRCA мутации.[36] Операции могут использоваться отдельно, в сочетании друг с другом или в сочетании с нехирургическими вмешательствами для снижения риска рака груди и яичников. Обратите внимание, что такие операции, как мастэктомия и овариэктомия, не полностью исключают возможность рака груди; Сообщается, что, несмотря на эти процедуры, случаи возникли.[37]
- Перевязка маточных труб является наименее инвазивной из этих операций и, по-видимому, снижает риск рака яичников для BRCA1 перевозчиками более чем на 60%. Сальпингэктомия - еще один вариант, который является более инвазивным, чем перевязка маточных труб, и может привести к дополнительному снижению риска. Оба эти действия можно выполнить в любое время после завершения деторождения.[36] В отличие от других профилактических операций, эти две операции не снижают риск рака груди.[38]
- Профилактическое (профилактический) мастэктомия связано с небольшими рисками и большим падением риска рака груди.
- Профилактическое сальпингоофорэктомия (удаление яичников и фаллопиевых труб) приводит к очень значительному снижению риска рака яичников и значительному снижению риска рака груди, если оно выполняется до естественной менопаузы. Однако это также сопряжено с риском серьезных побочных эффектов, если выполнять его в молодом возрасте.
- Гистерэктомия не имеет прямого воздействия на BRCAсвязанных с раком, но он позволяет женщинам использовать некоторые лекарства, снижающие риск рака груди (например, тамоксифен) с риском рак матки и использовать меньше гормонов для лечения побочных эффектов профилактической овариэктомии.
Решение о том, проводить ли какие профилактические операции и когда, - это сложное личное решение. Текущие медицинские знания предлагают некоторые рекомендации о рисках и преимуществах. Даже носители одной и той же мутации или из одной семьи могут иметь существенно разные риски в отношении вида и тяжести рака, которым они могут заболеть, а также возраста, в котором они могут им заболеть. У разных людей тоже разные ценности. Они могут сосредоточиться на общей профилактике рака, психологической пользе, текущем качестве жизни или общей выживаемости. Возможное влияние будущих медицинских достижений на лечение или прогноз также может иметь некоторое значение для очень молодых женщин и планирования семьи. Решение индивидуально и обычно основывается на многих факторах, таких как самое раннее появление BRCA-связанный рак у близких родственников.
Защитный эффект профилактических операций выше, если они проводятся в молодом возрасте; тем не менее, овариэктомия также имеет побочные эффекты, которые наиболее заметны, когда ее проводят задолго до естественной менопаузы. По этой причине овариэктомия в основном рекомендуется после 35 или 40 лет, при условии, что вынашивание ребенка завершилось. Риск рака яичников до этого возраста низок, а отрицательные последствия овариэктомии менее серьезны, поскольку женщина приближается к естественной менопаузе.[13][39]
- Для носителей повышенного риска BRCA1 Мутации, профилактическая овариэктомия в возрасте около 40 лет снижает риск рака яичников и груди и дает существенное преимущество в долгосрочной выживаемости. Проведение этой операции в очень молодом возрасте не дает или почти не дает дополнительных преимуществ в плане выживаемости, но усиливает побочные эффекты операции. По сравнению с отсутствием вмешательства, эта операция в возрасте около 40 лет увеличивает шанс женщины достичь 70-летнего возраста на пятнадцать процентных пунктов, с 59% до 74%. Добавление профилактической мастэктомии увеличивает ожидаемую выживаемость еще на несколько процентных пунктов.
- Для носителей повышенного риска BRCA2 мутации, овариэктомия в возрасте около 40 лет имеет меньший эффект. Операция увеличивает шанс женщины достичь 70-летнего возраста всего на пять процентных пунктов, с 75% до 80%. Когда вместо этого в 40 лет выполняется только профилактическая мастэктомия, улучшение будет таким же, с ожидаемым шансом увеличения с 75% до 79%. Ожидается, что совместное выполнение обеих операций в возрасте около 40 лет повысит шансы женщины на достижение 70-летнего возраста с 75% до 82%.
Для сравнения, вероятность дожить до 70 лет у женщин в общей популяции составляет 84%.
Исследования изучали влияние хирургических вмешательств на психологическое и социальное благополучие женщин с мутацией BRCA.[40] Из-за ограниченности доказательств метаанализ 2019 года не смог сделать выводы о том, могут ли вмешательства помочь с психологическими последствиями операции у женщин-носителей BRCA. Необходимы дополнительные исследования, чтобы сделать вывод о том, как лучше всего поддержать женщин, выбирающих операцию.[40]
Мастэктомия
У женщины, у которой не развился рак груди, удаление груди может снизить риск того, что когда-либо будет диагностирован рак груди, на 90%, до уровня, который составляет примерно половину среднего женского риска.[8]:209–244
Двусторонняя мастэктомия - это удаление обеих молочных желез хирург груди.[8]:209–244 В модифицированная радикальная мастэктомия используется только женщинам с диагнозом инвазивный рак груди. Техники профилактической мастэктомии включают:[8]:209–244
- Простая мастэктомия, который рекомендуется женщинам, которым не проводится реконструкция груди, оставляет наименьшее количество ткани груди в организме и, следовательно, обеспечивает наибольшее снижение риска. Помимо профилактического использования, его также используют женщины, у которых диагностировали более ранние стадии рака.
- Мастэктомия с сохранением кожи удаляет ткань груди, соска и ареолы, но оставляет «лишнюю» кожу на месте для восстановления. Он имеет менее заметную рубцовую ткань, чем простая мастэктомия.
- Мастэктомия с сохранением сосков удаляет ткань груди, но оставляет неповрежденными сосок и ареолу для более естественного вида.
- Подкожная мастэктомия удаляет ткань груди, но оставляет неповрежденными сосок и ареолу. Шрамы скрыты в инфрамаммарная складка под грудью.
- Мастэктомия с сохранением ареолы удаляет ткань груди и соски, но не ареолу.
- Нервосохраняющая мастэктомия это усилие по поддержанию нервов, которые обеспечивают ощущение кожи над грудью. Грудь, перенесшая любую из этих операций, имеет гораздо меньшие тактильные ощущения, чем естественная грудь. Нервосберегающие методы - это попытка сохранить некоторое ощущение в груди с ограниченным, а зачастую и частичным успехом.[8]:209–244
Выбор метода определяется наличием рака и общим состоянием здоровья, а также желанием женщины, если таковое имеется, операция по реконструкции груди в эстетических целях.[8]:209–244 Женщины, которые выбирают плоскую грудь или используют внешние протезы груди, обычно выбирают простую мастэктомию, с ее большим снижением риска.[8]:209–244
Реконструкция груди обычно выполняется Пластический хирург, и может быть начат как часть той же многочасовой операции по удалению груди. Было использовано несколько методов реконструкции с разным расположением и количеством рубцов. Некоторые техники используют ткань из другой части тела, например, жировую ткань из нижней части живота или, иногда, из мышц других частей туловища. Другие используют грудные импланты, возможно, предшествуют расширители ткани, чтобы обеспечить объем. Некоторые методы реконструкции требуют нескольких операций. Впоследствии у некоторых женщин татуировки добавлен для моделирования ареолы груди или изменить форму кожи, чтобы сформировать сосок.[8]:209–244
Сальпингоофорэктомия
Овариэктомия (хирургическое удаление яичников) и сальпингэктомия (хирургическое удаление фаллопиевых труб) настоятельно рекомендуется женщинам с BRCA мутации.[8]:275–302 Сальпингоофорэктомия - единственный наиболее эффективный метод профилактики рака яичников и маточных труб у женщин с BRCA мутация. Однако небольшой риск первичный рак брюшины остается, по крайней мере, среди женщин с BRCA1 мутации, так как слизистая оболочка брюшины состоит из клеток того же типа, что и части яичника. По оценкам, этот риск вызывает около пяти случаев рака брюшины на 100 женщин с опасными заболеваниями. BRCA1 мутации через 20 лет после операции.[8]:275–302
BRCA2 Связанный с этим рак яичников чаще встречается у женщин в перименопаузе или менопаузе, поэтому сальпингоофорэктомия рекомендуется в возрасте от 45 до 50 лет.[8]:275–302 Если это делается до менопаузы, то женщины также получают выгоду от снижения риска рака груди.
Операция часто проводится в сочетании с гистерэктомия (хирургическое удаление матки), а иногда и цервицэктомия (хирургическое удаление шейка матки), особенно у женщин, которые хотят принимать тамоксифен, который, как известно, вызывает рак матки, или у кого миома матки.[8]:275–302 Доступны несколько стилей хирургии, в том числе: лапароскопический (замочная скважина) хирургия. Потому что около 5% женщин с BRCA мутации не выявили рак яичников во время запланированной операции, операцию следует рассматривать, как если бы она была удалением известного рака.[8]:275–302
Сальпингоофорэктомия делает женщину стерильный (не может иметь детей). Бесплодие услуги можно использовать, чтобы сохранить ее яйца, если бы захотел. Однако, поскольку преимущества операции наиболее близки к наступлению менопаузы, большинство женщин просто откладывают операцию до тех пор, пока они не родят столько детей, сколько захотят.[8]:275–302
Операция также искусственно вызывает менопаузу, что вызывает приливы, нарушения сна, перепады настроения, сухость влагалища, сексуальные трудности, трудности с запоминанием слов и другие медицинские признаки и симптомы. Побочные эффекты варьируются от легких до тяжелых; большинство из них можно вылечить хотя бы частично. Многие женщины с BRCA брать заместительная гормональная терапия для уменьшения этих эффектов: комбинации эстроген-прогестерон для женщин с маткой и беспрепятственный эстроген для женщин, у которых была удалена матка. Эстроген может вызвать рак груди, но, поскольку количество принятого эстрогена меньше количества, вырабатываемого теперь удаленными яичниками, чистый риск обычно считается приемлемым.[8]:303–317
Некоторые источники предполагают, что овариэктомия в возрасте до 50 лет удваивает риск сердечно-сосудистых заболеваний и увеличивает риск переломов бедра, вызванного остеопорозом, в соответствующей популяции.[13]
Немедицинские варианты
Учитывая высокие риски и низкую пользу выбора образа жизни в BRCA носители мутации, отсутствие образа жизни обеспечивает достаточную защиту.[8]:113–142
Рождение первого ребенка в более молодом возрасте, наличие большего числа детей, чем в среднем, и кормление грудью более одного года снижает риск рака груди для женщины среднего риска.[8]:113–142 Исследования об этом эффекте среди BRCA носители мутации дали противоречивые результаты, но в целом считается, что рождение детей обеспечивает слабую защиту от рака молочной железы или ее отсутствие для женщин с BRCA1 мутации, и парадоксальным образом увеличить риск рака груди у женщин с BRCA2 мутации.[8]:113–142[16]
Физическая активность и поддержание здоровой массы тела предотвращает рак груди и другие виды рака у населения в целом, а также предотвращает сердечные заболевания и другие заболевания. Среди женщин с BRCA мутация, физическая активность и здоровая масса тела в подростковом возрасте не влияют на рак яичников и задерживают, но не полностью предотвращают рак груди после менопаузы.[8]:113–142[41] В некоторых исследованиях только значительные и интенсивные упражнения приносили пользу.[8]:113–142 Ожирение и увеличение веса во взрослом возрасте связано с диагнозом рака груди.[8]:113–142
Исследования конкретных продуктов питания, диет или пищевые добавки как правило, предоставили противоречивую информацию или, в случае диетический жир, соя потребление и питье зеленый чай, проводились только у женщин среднего риска.[8]:113–142 Единственное диетическое вмешательство, которое обычно считается профилактикой рака груди у BRCA носители мутации сводят к минимуму потребление Алкогольные напитки. Употребление более одного алкогольного напитка в день тесно связано с более высоким риском развития рака груди, и носителям обычно рекомендуется употреблять не более одного алкогольного напитка в день, а всего не более четырех в неделю.[8]:113–142
В исследовании, проведенном с еврейскими женщинами ашкенази, было замечено, что носители мутаций, родившиеся до 1940 года, имеют гораздо меньший риск диагностирования рака груди к 50 годам, чем те, кто родился после 1940 года; это также наблюдалось в популяции, не являющейся носителем.[41] Причины разницы неизвестны. В отличие от населения в целом возраст менархе и возраст наступления менопаузы не влияет на риск рака груди для BRCA носители мутации.[8]:113–142
Эволюционное преимущество
Несколько гипотез предполагают, что BRCA мутации могут иметь эволюционные преимущества, такие как более высокий интеллект. Гипотеза разведки ашкенази была предложена Грегори Кокран и утверждает, что дефект в BRCA1 ген может вызвать рост нервной системы.[42]
Исследования показали, что BRCA1 мутации не случайны, а являются результатом адаптивного отбора, что указывает на то, что хотя BRCA1 мутации связаны с раком груди, и, вероятно, мутации также имеют положительный эффект.[43]
Патенты
Заявка на патент на изолированное BRCA1 гены и мутации, способствующие развитию рака, описанные выше, а также методы диагностики вероятности возникновения рака груди были поданы Университетом штата Юта, Национальным институтом наук об окружающей среде (NIEHS) и Мириады генетики в 1994 г .;[4] В течение следующего года Myriad в сотрудничестве с исследователями из Endo Recherche, Inc., HSC Research & Development Limited Partnership и Университета Пенсильвании изолировали и секвенировали BRCA2 ген и выявили ключевые мутации, а также первые BRCA2 патент был подан в США Myriad и другими учреждениями в 1995 году.[5] Myriad является эксклюзивным лицензиатом этих патентов и применяет их в США против клинико-диагностических лабораторий.[7] Эта бизнес-модель привела к тому, что Myriad из стартапа в 1994 году выросла до публичной компании с 1200 сотрудниками и годовым доходом около 500 миллионов долларов в 2012 году;[6] это также привело к спорам по поводу высоких цен и невозможности получить второе мнение из других диагностических лабораторий, что, в свою очередь, привело к появлению вехи Ассоциация молекулярной патологии против Myriad Genetics иск.[7][44] Срок действия патентов истекает в 2014 году.
Согласно статье, опубликованной в журнале Genetic Medicine в 2010 году, «Патентная история за пределами Соединенных Штатов более сложна ... Например, патенты были получены, но патенты игнорируются провинциальными системами здравоохранения Канады. В Австралии и Великобритании лицензиат Myriad разрешил использование системы здравоохранения, но объявил об изменении планов в августе 2008 года. ... В единственном общеевропейском патенте Myriad запатентована только одна мутация, хотя некоторые патенты все еще находятся на рассмотрении. процедура возражения. По сути, Соединенные Штаты являются единственной юрисдикцией, где сильная патентная позиция Myriad предоставила статус единственного поставщика ".[45][46] Питер Мелдрам, генеральный директор Myriad Genetics, признал, что Myriad имеет «другие конкурентные преимущества, которые могут сделать такое [патентное] обеспечение ненужным» в Европе.[47]
Юридические решения, касающиеся BRCA1 и BRCA2 патенты повлияют на область генетического тестирования в целом.[48] В июне 2013 г. Ассоциация молекулярной патологии против Myriad Genetics (№ 12-398), Верховный суд США единогласно постановил, что «встречающийся в природе сегмент ДНК является продуктом природы, а не патентоспособный просто потому, что он был изолирован, "аннулируя патенты Myriad на гены BRCA1 и BRCA2. Однако суд также постановил, что манипулирование геном с целью создания чего-то, чего не встречается в природе, все еще может иметь право на патентную защиту.[49]
Смотрите также
Рекомендации
- ^ Холли Ян (14 мая 2013 г.). «Какой ген привел к двойной мастэктомии Анджелины Джоли?». Здоровье. CNN.
- ^ "BRCA1 и BRCA2: Риск рака и генетическое тестирование ». Национальный институт рака. 29 мая 2009 г.
- ^ а б c Вайцель Дж. Н., Лагос В. И., Куллинэйн Калифорния, Гамбол П. Дж., Калвер Дж. О., Блейзер К. Р., Паломарес М. Р., Лоустутер К. Дж., Макдональд Д. Д. (2007). "Ограниченная семейная структура и BRCA Статус мутации генов в единичных случаях рака груди ». Журнал Американской медицинской ассоциации. 297 (23): 2587–2595. Дои:10.1001 / jama.297.23.2587. PMID 17579227.
- ^ а б US5747282
- ^ а б US5837492
- ^ а б Страница Myriad Investor - см. «Краткий обзор Myriad» В архиве 18 октября 2012 г. Wayback Machine по состоянию на октябрь 2012 г.
- ^ а б c Шварц Дж. (12 мая 2009 г.). «Больные раком бросают вызов патентованию гена». Нью-Йорк Таймс.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар в качестве в au средний ау топор ай az ба bb до н.э bd быть парень bg бх би Ъ bk бл бм млрд бо Моррис, Джой Л .; Гордон, Ора К. (2010). Положительные результаты: принятие наилучших решений, когда вы подвержены высокому риску рака груди или яичников. Амхерст, Нью-Йорк: Книги Прометея. ISBN 978-1-59102-776-8.
- ^ Chen, S .; Пармиджани, Г. (апрель 2007 г.). «Мета-анализ BRCA1 и BRCA2 пенетрантность ». J Clin Oncol. 25 (11): 1329–33. Дои:10.1200 / JCO.2006.09.1066. ЧВК 2267287. PMID 17416853.
- ^ Veronesi, A .; De Giacomi, C.D .; Magri, M.D .; Lombardi, D .; Zanetti, M .; Scuderi, C .; Dolcetti, R .; Viel, A .; Crivellari, D .; Bidoli, E .; Бойокки, М. (2005). «Семейный рак груди: характеристики и исходы BRCA 1-2 положительных и отрицательных случаев». BMC Рак. 5: 70. Дои:10.1186/1471-2407-5-70. ЧВК 1184063. PMID 15996267.
- ^ Будрони, М .; Cesaraccio, R .; Coviello, V .; Sechi, O .; Пирино, Д .; Cossu, A .; Танда, Ф .; Пизано, М .; Palomba, G .; Пальмиери, Г. (2009). «Роль мутационного статуса BRCA2 в общей выживаемости среди больных раком груди из Сардинии». BMC Рак. 9: 62. Дои:10.1186/1471-2407-9-62. ЧВК 2653541. PMID 19232099.
- ^ Verhoog, L.C .; Brekelmans, C.T .; Сейнив, С .; Van Den Bosch, L.M .; Dahmen, G .; Ван Гил, А. Н .; Тиланус-Линторст, М. М .; Bartels, C.C .; Вагнер, А .; Van Den Ouweland, A .; Devilee, P .; Meijers-Heijboer, E.J .; Клин, Дж. Г. (1998). «Выживаемость и опухолевые характеристики больных раком груди с мутациями зародышевой линии BRCA1». Ланцет. 351 (9099): 316–321. Дои:10.1016 / S0140-6736 (97) 07065-7. PMID 9652611. S2CID 38655517.
- ^ а б c d е ж грамм Куриан, А.В.; Сигал, БМ; Плеврит, СК (январь 2010 г.). "Анализ выживаемости стратегий снижения риска рака для BRCA1/ 2 носителя мутации ". J Clin Oncol. 28 (2): 222–31. Дои:10.1200 / JCO.2009.22.7991. ЧВК 2815712. PMID 19996031.
- ^ а б c d е Friedenson B (2005). "BRCA1 и BRCA2 пути и риск рака, отличного от рака груди или яичников ». МедГенМед. 7 (2): 60. ЧВК 1681605. PMID 16369438.
- ^ а б Friedenson B (2007). "The BRCA1/ 2 путь предотвращает гематологический рак в дополнение к раку груди и яичников ». BMC Рак. 7: 15. Дои:10.1186/1471-2407-7-152. ЧВК 1959234. PMID 17683622. Сложить резюме – В BRCA1 / 2 путь предотвращает лейкемии и лимфомы (Видео).
- ^ а б c d е ж грамм час я j k л м п Фишман А (октябрь 2010 г.). «Влияние паритета, грудного вскармливания и лечения бесплодия на риск наследственного рака груди и яичников: обзор». Int. J. Gynecol. Рак. 20 (11 Прил. 2): S31–3. Дои:10.1111 / IGC.0b013e3181f60d4d. PMID 20975359. S2CID 42755864.
- ^ Пал Т., Киф Д., Сан П., Народ С.А. (апрель 2010 г.). "Фертильность у женщин с BRCA мутации: исследование случай-контроль ". Fertil. Стерил. 93 (6): 1805–8. Дои:10.1016 / j.fertnstert.2008.12.052. PMID 19200971.
- ^ Broer, S.L .; Broekmans, F. J. M .; Laven, J. S. E .; Фаузер, Б. К. Дж. М. (2014). «Антимюллеров гормон: исследование резерва яичников и его потенциальные клинические последствия». Обновление репродукции человека. 20 (5): 688–701. Дои:10.1093 / humupd / dmu020. ISSN 1355-4786. PMID 24821925.
- ^ Октай, К; Ким, JY; Барад, Д; Бабаев С.Н. (январь 2010 г.). "Ассоциация BRCA1 мутации с скрытой первичной недостаточностью яичников: возможное объяснение связи между бесплодием и риском рака груди / яичников ». J Clin Oncol. 28 (2): 240–4. Дои:10.1200 / JCO.2009.24.2057. ЧВК 3040011. PMID 19996028.
- ^ Мослехи, Р; Сингх, Р. Лесснер, Л; Фридман, Дж. М. (март – апрель 2010 г.). "Влияние BRCA мутации женской фертильности и соотношения полов в потомстве ". Am J Hum Biol. 22 (2): 201–5. Дои:10.1002 / ajhb.20978. ЧВК 3739697. PMID 19642207.
- ^ Балманья, Юдифь; Диес, Орланд; Кампос, Берта; Маевский, Магдалена; Санс, Юдит; Алонсо, Кармен; Байге, Монтсеррат; Гарбер, Джуди Э. (август 2005 г.). «Искажение соотношения полов у потомков из семей с мутантными аллелями BRCA1 или BRCA2: феномен систематической ошибки установления?». Исследования и лечение рака груди. 92 (3): 273–277. Дои:10.1007 / s10549-005-3377-х. ISSN 0167-6806. PMID 16155798. S2CID 21830848.
- ^ Агнесе, Д. М. (март 2006 г.). «Битва за соотношение полов BRCA1 / BRCA2 (потомство): правда или последствия». Журнал медицинской генетики. 43 (3): 201–202. Дои:10.1136 / jmg.2004.028977. ISSN 0022-2593. ЧВК 2563236. PMID 16033919.
- ^ Коцопулос Дж., Любишнки Дж., Салмена Л. и др. (Март 2012 г.). «Грудное вскармливание и риск рака груди в BRCA1 и BRCA2 Носители мутаций ». Рак груди Res. 14 (2): R42. Дои:10.1186 / bcr3138. ЧВК 3446376. PMID 22405187. Сложить резюме – Телеграф (29 марта 2012 г.).
- ^ Йошида К., Мики Ю. Мики (ноябрь 2004 г.). "Роль BRCA1 и BRCA2 как регуляторы репарации ДНК, транскрипции и клеточного цикла в ответ на повреждение ДНК " (PDF). Наука о раке. 95 (11): 866–71. Дои:10.1111 / j.1349-7006.2004.tb02195.x. PMID 15546503. S2CID 24297965. Архивировано из оригинал (PDF) 20 августа 2005 г.
- ^ Цуй, Дж; Антониу, AC; Дите, GS; Саути, MC; Вентер, диджей; Истон, Д. Ф.; Giles, GG; Маккреди, MR; Хоппер, JL (февраль 2001 г.). "После BRCA1 и BRCA2-что дальше? Многофакторный анализ сегрегации трех поколений популяционных австралийских семей, пострадавших от рака груди у женщин ". Am J Hum Genet. 68 (2): 420–31. Дои:10.1086/318187. ЧВК 1235275. PMID 11133358.
- ^ Гринберг Р.А. (сентябрь 2006 г.). "BRCA мутации и детский рак ". Cancer Biol. Ther. 5 (9): 1103–4. Дои:10.4161 / cbt.5.9.3370. ЧВК 2703724. PMID 17012842.
- ^ Целевая группа превентивных служб США; Оуэнс, ДК; Дэвидсон, KW; Крист, AH; Барри, MJ; Cabana, M; Caughey, AB; Дубени, Калифорния; Эплинг Дж. У., младший; Кубик, М; Ландефельд, CS; Mangione, CM; Пберт, L; Сильверштейн, М; Саймон, Массачусетс; Ценг, CW; Вонг, Дж.Б. (20 августа 2019 г.). «Оценка риска, генетическое консультирование и генетическое тестирование рака, связанного с BRCA: Рекомендация рабочей группы США по профилактическим услугам». JAMA. 322 (7): 652–665. Дои:10.1001 / jama.2019.10987. PMID 31429903.
- ^ Pagon, RA .; Адам, депутат; Ardinger, HH .; Bird, TD .; Долан, CR .; Fong, CT .; Smith, RJH .; Стивенс, К .; Petrucelli, N .; Smith, R. J. H .; Стивенс, К. (1993). BRCA1 и BRCA2 Наследственный рак груди и яичников. Энциклопедия рака. С. 381–385. Дои:10.1016 / b0-12-227555-1 / 00090-3. ISBN 9780122275555. PMID 20301425.
- ^ Розенберг, Шошана М .; Радди, Кэтрин Дж .; Tamimi, Rulla M .; Гелбер, Шари; Шапира, Лидия; Пойдем, Стивен; Borges, Вирджиния Ф .; Ларсен, Брайс; Гарбер, Джуди Э. (11 февраля 2016 г.). «Тестирование мутаций BRCA1 и BRCA2 у молодых женщин с раком груди». JAMA Онкология. 2 (6): 730–6. Дои:10.1001 / jamaoncol.2015.5941. ISSN 2374-2445. ЧВК 5002892. PMID 26867710.
- ^ «Рекомендации по направлению - генетика рака». www.gosh.nhs.uk. Получено 21 февраля 2016.
- ^ Pijpe, A .; Andrieu, N .; Истон, Д. Ф .; Kesminiene, A .; Cardis, E .; Noguès, C .; Gauthier-Villars, M .; Lasset, C .; Fricker, J. -P .; Peock, S .; Frost, D .; Evans, D.G .; Eeles, R.A .; Paterson, J .; Manders, P .; Van Asperen, C.J .; Ausems, M. G. E. M .; Meijers-Heijboer, H .; Thierry-Chef, I .; Hauptmann, M .; Goldgar, D .; Rookus, M. A .; Ван Леувен, Ф. Э. (2012). «Воздействие диагностического излучения и риск рака груди среди носителей мутации BRCA1 / 2: ретроспективное когортное исследование (GENE-RAD-RISK)». BMJ. 345: e5660. Дои:10.1136 / bmj.e5660. ЧВК 3435441. PMID 22956590.
- ^ Lynch, H.T .; Кейси, М. Дж .; Snyder, C.L .; Bewtra, C .; Lynch, J. F .; Обухов, М .; Годвин, А. К. (2009). «Наследственная карцинома яичников: гетерогенность, молекулярная генетика, патология и лечение». Молекулярная онкология. 3 (2): 97–137. Дои:10.1016 / j.molonc.2009.02.004. ЧВК 2778287. PMID 19383374.
- ^ а б Moorman, P.G .; Havrilesky, L.J .; Gierisch, J.M .; Coeytaux, R. R .; Лоури, У. Дж .; Peragallo Urrutia, R .; Динан, М .; McBroom, A.J .; Hasselblad, V .; Сандерс, Г. Д .; Майерс, Э. Р. (2013). «Оральные контрацептивы и риск рака яичников и рака груди среди женщин из группы высокого риска: систематический обзор и метаанализ». Журнал клинической онкологии. 31 (33): 4188–98. Дои:10.1200 / JCO.2013.48.9021. PMID 24145348.
- ^ а б Йодис, Симона; Бариль, Моника; Ротменс, Николь; Ферос, Ирэн; Бонанни, Бернардо; Радис, Паоло; Бернард, Лорис; Maisonneuve, Патрик; Гандини, Сара (август 2010). «Использование оральных контрацептивов и риск рака груди или яичников у носителей BRCA1 / 2: метаанализ». Европейский журнал рака. 46 (12): 2275–2284. Дои:10.1016 / j.ejca.2010.04.018. PMID 20537530.
Лу, Карен Х .; Берчук, Эндрю; Кауфф, Ноа Д. (7 мая 2013 г.). «Наследственные гинекологические раки». В Баракате, Ричард Д .; Берчук, Эндрю; Маркман, Мори; Рэндалл, Маркус Э. (ред.). Принципы и практика гинекологической онкологии (6-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. ISBN 978-1-4698-3148-0.
Айзекс, Клодин; Флетчер, Сюзанна В .; Пескин, Бет Н. (май 2013 г.). Hayes, Daniel F .; Дуда, Розмари Б. (ред.). «Лечение наследственного синдрома рака груди и яичников и пациентов с мутациями BRCA». Уолтем, Массачусетс: UpToDate. Получено 13 июн 2013.
Редакционная коллегия PDQ Cancer Genetics (7 июня 2013 г.). «PDQ Генетика рака груди и яичников (версия для медицинских работников)». Бетесда, штат Мэриленд: Национальный институт рака.. Получено 13 июн 2013. - ^ Сибула, Дэвид; Зикан, Михал; Дусек, Ладислав; Майек, Ондрей (август 2011 г.). "Оральные контрацептивы и риск рака яичников и груди в BRCA носители мутации: метаанализ ». Экспертный обзор противоопухолевой терапии. 11 (8): 1197–1207. Дои:10.1586 / эра.11.38. PMID 21916573. S2CID 31012428.
- ^ а б Pruthi, S .; Gostout, B.S .; Линдор, Н. М. (2010). «Выявление и лечение женщин с мутациями BRCA или наследственной предрасположенностью к раку груди и яичников». Труды клиники Мэйо. 85 (12): 1111–1120. Дои:10.4065 / mcp.2010.0414. ЧВК 2996153. PMID 21123638.
- ^ Берк, Уайли (26 марта 1997 г.). «Рекомендации по последующему наблюдению за людьми с наследственной предрасположенностью к раку: Ii. Brca1 и brca2». JAMA. 277 (12): 997–1003. Дои:10.1001 / jama.1997.03540360065034. ISSN 0098-7484. PMID 9091675.
- ^ Kwon, J. S .; Тинкер, А .; Pansegrau, G .; McAlpine, J .; Housty, M .; McCullum, M .; Гилкс, К. Б. (2013). «Профилактическая сальпингэктомия и отсроченная овариэктомия как альтернатива носителям мутации BRCA». Акушерство и гинекология. 121 (1): 14–24. Дои:10.1097 / AOG.0b013e3182783c2f. PMID 23232752. S2CID 41081248.
- ^ Stadler, ZK .; Кауфф, Н.Д. (Январь 2010 г.). "Варианты взвешивания для снижения риска рака у носителей BRCA1 и BRCA2 мутации ». J Clin Oncol. 28 (2): 189–91. Дои:10.1200 / JCO.2009.25.6875. PMID 19996025.
- ^ а б Джефферс, Лиза; Рид, Джоанна; Фитцсимонс, Донна; Моррисон, Патрик Дж; Демпстер, Мартин (9 октября 2019 г.). «Вмешательства для улучшения психосоциального благополучия женщин-носителей мутации BRCA после операции по снижению риска». Кокрановская база данных систематических обзоров. 10: CD012894. Дои:10.1002 / 14651858.cd012894.pub2. ISSN 1465-1858. ЧВК 6784162. PMID 31595976.
- ^ а б Король, MC; Marks, JH; Манделл, Дж. Б. (октябрь 2003 г.). "Риск рака груди и яичников из-за наследственных мутаций в BRCA1 и BRCA2". Наука. 302 (5645): 643–6. Bibcode:2003Наука ... 302..643K. Дои:10.1126 / science.1088759. PMID 14576434. S2CID 33441900.
- ^ Cochran, G .; Харди, Дж .; Харпендинг, Х. (2006).«Естественная история ашкеназской разведки». Журнал биосоциальной науки. 38 (5): 659–693. CiteSeerX 10.1.1.163.3711. Дои:10.1017 / S0021932005027069. PMID 16867211.
- ^ Huttley GA, Easteal S, Southey MC, Tesoriero A, Giles GG, McCredie MR, Hopper JL, Venter DJ (2000). «Адаптивная эволюция супрессора опухолей BRCA1 у людей и шимпанзе. Австралийское семейное исследование рака груди». Nat. Genet. 25 (4): 410–3. Дои:10.1038/78092. PMID 10932184. S2CID 10004449.
- ^ «ACLU подает в суд на патенты на гены рака груди». CNN. В архиве из оригинала 15 мая 2009 г.. Получено 14 мая 2009.
- ^ Роберт Кук-Диган, доктор медицины; и другие. (2010). «Влияние патентов на гены и практики лицензирования на доступ к генетическому тестированию на наследственную предрасположенность к раку: сравнение рака груди и яичников с раком толстой кишки: патенты и лицензирование для тестирования на рак груди, яичников и толстой кишки». Genet. Med. 12 (4 Приложение): S15 – S38. Дои:10.1097 / GIM.0b013e3181d5a67b. ЧВК 3047448. PMID 20393305.
- ^ Беновиц С. (январь 2003 г.). "Европейские группы выступают против последнего патента Myriad на BRCA1". J. Natl. Институт рака. 95 (1): 8–9. Дои:10.1093 / jnci / 95.1.8. PMID 12509391.
- ^ Конли Дж., Ворхоус Д., Кук-Диган Дж. (1 марта 2011 г.). "Как Myriad отреагирует на следующее поколение BRCA Тестирование? ". Робинсон, Брэдшоу и Хинсон. Получено 9 декабря 2012.
- ^ «Генетика и патентование». Информация о проекте "Геном человека". Геномные программы Министерства энергетики США. 7 июля 2010 г.
- ^ Липтак, Адам (13 июня 2013 г.). «Верховный суд постановил, что гены человека не могут быть запатентованы». Нью-Йорк Таймс. Получено 13 июн 2013.
внешняя ссылка
- БОАДИСЕЯ, инструмент оценки риска семейного рака груди и яичников
- BRCA1 и BRCA2 на Лабораторные тесты онлайн
- Обмен BRCA, большая база данных вариантов BRCA1 и BRCA2 с классификациями патогенности.